







ЧТО ЖЕ ДАЛЬШЕ?
Покров тайны чуть-чуть приоткрылся, когда речь шла о природе терапевтического
действия ГНЛ (излучение при 633 нм). СОД и гематопорфирин, два возможных
рецептора фотонов, действительно обладают небольшим поглощением при данной
длине волны. Но как объяснить терапевтическое действие инфракрасного лазера,
излучение которого лежит при 904 нм, где нет полос поглощения, связанных
с электронными переходами у биологически важных молекул? Здесь получены
лишь самые первые результаты. Исследования продолжаются.
Устройство и принцип действия лазеров.
Основными элементами (деталями) лазера являются лазерное вещество (рабочее
тело), два зеркальных резонатора (непроницаемый и полупроницаемый), лампа
накачки (источник света), конденсатор и источник питания (электрический,
химический и др.). Классическим представителем лазеров является рубиновый
лазер, в котором в качестве лазерного вещества используют рубиновый (искусственный)
стержень.
Действие лазера заключается в том, что при работе лампы накачки (например,
ксеноновой) мощный поток света (фотонов) приводит атомы хрома, которые
составляют основу кристаллов рубина, в возбужденное состояние. Возвращаясь
в основное (исходное) состояние, атомы хрома излучают фотоны, которые сталкиваются
с возбужденными атомами хрома, выбивая из них другие фотоны. В свою очередь
эти фотоны, встречаясь с другими возбужденными атомами хрома, также выбивают
фотоны, и процесс лавинообразно нарастает (по типу цепной реакции). Поток
фотонов выходит за пределы торцов рубинового стержня, многократно отражаясь
от зеркальных резонаторов, и усиливается до уровня, при котором плотность
потока световой энергии достигает предельного значения, достаточного для
преодоления полупрозрачного зеркального резонатора. Излучение выходит за
его пределы в виде монохроматического когерентного излучения - лазерного
света с длиной волны 0,69 мкм, т.е. в предельно узком диапазоне красного
света. В этом выражается первое (основное) свойство лазерного света - его
монохроматичность, т.е. генерация светового луча в определенной, предельно
узкой полосе светового спектра.
Другое важное свойство лазерного света - его когерентность, т.е. упорядоченность
по амплитуде (высоте) и длине (частоте) волны. Третьим свойством лазерного
света является его поляризованность. Наконец, четвертое свойство, очень
важное в практическом отношении, малый угол расхождения лазерного луча.
Оптическая фокусировка позволяет достигнуть в тончайшем (до 25 мкм) лазерном
луче высокой концентрации световой энергии (при температуре до нескольких
тысяч градусов), что дает возможность рассекать ткани организма, разрезать
и сваривать металлы (например, при изготовлении зубных протезов).
Таким образом, лазерный луч по физическим свойствам не имеет ничего
общего с радиоактивным, рентгеновским или космическим излучением и по своей
природе близок к таким естественным лечебным факторам, как соллюкс, минеральная
вода, лечебные грязи, лекарственные растения. В процессе эволюции организм
человека адаптировался к солнечному свету. Более того, солнечный свет является
источником жизни всего живого на Земле.
Указанные выше физические уникальные свойства лазерного света обусловливают
широкий диапазон его профилактического и лечебного действия.
Лазерные излучатели по агрегатному состоянию подразделяют на несколько
видов. Твердотельные излучатели - это в основном стекло (оптический кварц),
активированный неодимом, эрбием, гольмием и другими элементами. К газовым
лазерам относятся такие широко распространенные, как гелий-неоновые, гелий-кадмиевые,
аргоновые, углекислотные и др. Жидкостные лазеры - это различные пигменты
(например, родамин), растворенные в органических растворителях (этиловый
спирт, кумарин, флюоресценты, карбостирол и др.). Наконец, широко распространены
полупроводниковые (инжекционные) лазеры.
Энергию (мощность) лазерного света непрерывной генерации обычно измеряют
в ваттах (Вт) или милливаттах (мВт). При дозиметрии обычно используют такие
параметры, как плотность потока мощности (ППМ), т.е. единицу световой энергии
на единицу площади, и выражают ее в ваттах на 1 м2 (Вт/м2) или милливаттах
на 1 см2 (для низкоинтенсивных лазеров). Используют также единицу измерения
джоуль (Дж), т.е. ватт на 1 м2 в секунду (Вт/м2). Импульсный лазерный свет
измеряют в ваттах на импульс (Вт/имп) или в джоулях на импульс (Дж/имп).
Длительность импульсов измеряют в секундах, милли- и микросекундах. Частоту
следования импульсов определяют в герцах (Гц) и килогерцах (кГц). При расчетах
поглощенной тканями организма дозы световой лазерной энергии используют
комплекс указанных выше параметров, а также величины экспозиции (измеряемой
обычно в минутах и секундах). Варьирование этими параметрами в различных
сочетаниях позволяет подбирать пиковые и оптимальные параметры для профилактики
и лечения заболеваний, адекватные нозологическим особенностям заболеваний,
их формам (тяжести) и другим особенностям возникновения и течения. В настоящее
время используют компьютерно-лазерные системы.
Лазерная техника, применяемая в стоматологии.
В клинической стоматологии используют широкий комплекс современной
лазерной техники, которая представлена шестью основными типами: 1) лазерные
физиотерапевтические аппараты с газовыми излучателями (например, гелий-неоновые,
типа УЛФ-01, "Исток", ЛЕЕР и др.), полупроводниковые, наиболее распространенные
(например, АЛТП-1, АЛТП-2, "Оптодан" и др.); 2) лазерный аппарат "Оптодан",
с помощью которого также можно проводить магнитолазерную терапию, используя
специальную серийно выпускаемую магнитную насадку мощностью до 50 мТ; 3)
специализированные лазерные аппараты типа АЛОК для внутривенного облучения
крови. В настоящее время они применяются реже, так как широко внедряется
новая патентованная, более эффективная методика чрезкожного облучения крови
в зоне каротидных синусов с помощью лазерного аппарата "Оптодан"; 4) лазерные
аппараты для лазерной рефлексотерапии, например типа "Нега" (двухканальный),
"Контакт". С этой же целью можно применять аппарат "Оптодан" со специальными
световодными насадками для рефлексотерапии; 5) лазерные хирургические аппараты
(по типу лазерного скальпеля) нового поколения типа "Доктор" или аппарат
"Ланцет" с компьютерным управлением; 6) лазерные технологические установки
типа "Квант" и др. для лазерных технологий изготовления зубных протезов.
Все указанные лазерные аппараты разрешены к применению в стоматологии
Комитетом по новой медицинской технике Минздрава РФ, имеют лицензию Минздрава
РФ и сертификат Росстандарта. Эти аппараты укомплектованы разработанными
ЦНИИС инструкциями и методическими рекомендациями по профилактике и лечению
стоматологических заболеваний, утвержденными Минздравом РФ. Применение
лазерной техники в лечебных учреждениях регламентируется также Санитарными
правилами устройства и эксплуатации лазеров № 5804-91, утвержденными Госсанэпиднадзором
Минздрава РФ.
Механизмы профилактического и лечебного действия лазерного света.
Свет физиотерапевтических лазеров. Физиотерапевтические лазерные низкоинтенсивные
аппараты относятся к светолечебным приборам и генерируют лазерные лучи
с длинами волн 0,63; 0,85; 0,95; 1,3 мкм в непрерывном или импульсном режиме
мощностью от 0,1 до 2-4 Вт. Генерацию лазерного света в непрерывном или
импульсном режиме осуществляют с частотой от 0,1 до 3 кГц.
Импульсный лазерный свет полупроводниковых лазеров по сравнению с непрерывным
режимом обладает более эффективным профилактическим и лечебным действием,
так как его основные параметры (величина энергии в импульсе, длительность
и частота следования импульсов, экспозиции) позволяют более дифференцирование
подобрать пиковые и оптимальные параметры лазерного света при различных
заболеваниях. Кроме того, важным свойством импульсного света этих лазеров
является его способность проникать в ткани на значительную (до 6 см) глубину
по сравнению, например, со светом гелий-неонового лазера, который проникает
на глубину не более 2 мм (в когерентном качестве).
Импульсный лазерный свет оказывает широкое профилактическое и лечебное
действие: он дает выраженный противовоспалительный и противоотечный эффект,
нормализует микроциркуляцию, снижает проницаемость сосудистых стенок, обладает
фибрино- и тромболитическими свойствами, стимулирует метаболизм и повышает
содержание кислорода в тканях, стимулирует регенерацию (ускоряет заживление
травм, ран), предотвращает образование избыточных рубцов (в том числе келоидных)
после операций и травм, оказывает нейротропное, аналгезирующее, миорелаксирующее,
десенсибилизирующее, бактериостатическое и бактерицидное действие, стимулирует
систему иммунной защиты, снижает патогенность микрофлоры, повышает ее чувствительность
к антибиотикам и т.п.
Кроме того, импульсный лазерный свет обладает выраженным общим (общеукрепляющим)
действием, что очень важно при лечении сочетанных поражений (ранений) одновременно
с фоновыми и сопутствующими заболеваниями, при лечении ослабленных пациентов,
особенно детей и лиц пожилого возраста.
Лазерная физиотерапия в отличие от комплексного лечения относится к
патогенетической многофакторной терапии, сущность которой заключается в
одновременном (сочетанием) воздействии многих эффективных факторов на основные
(инициальные) патогенетические звенья механизмов заболеваний и патологических
процессов. Эффективность патогенетической многофакторной терапии по сравнению
с традиционным лечением достаточно высока.
Механизмы магнитолазерной терапии. В последнее время этот метод профилактики
и лечения получил широкое распространение, что обусловлено доступностью
и высокой эффективностью его. Сущность магнитолазерной терапии заключается
не просто В сочетанном влиянии лазерного света и магнитного поля, а во
взаимно потенцированном воздействии этих двух физических факторов, обусловливающих
их качественно новые лечебные свойства. Например, магнитолазерное излучение
наиболее эффективно купирует явления экссудации (отек), стимулирует тканевой
метаболизм, ускоряет регенерацию тканей (заживление травм, ран) по сравнению
с изолированным воздействием лазерного света и магнитных полей.
Механизмы лечебного действия лазерной рефлексотерапии. Основные механизмы
лазерной рефлексотерапии обусловлены выраженным нейротропным действием
импульсного лазерного света. В зависимости от величины энергии, длительности
и частоты следования импульсов лазерный свет может ускорять или замедлять
проведение нервных импульсов по нервным волокнам, стволам и синапсам, активизировать
функции нервных ганглиев и свободных нервных окончаний с секрецией адреналина
и ацетилхолина (соответственно при воздействии на симпатические и парасимпатические
отделы нервной системы). Энергетические и резонансные характеристики лазерного
света адекватны таковым клеток биологически активных точек (точки акупунктуры).
Таким образом, лазерное излучение является адекватным физиологическим раздражителем
в отличие от игло-, термо- и электропунктуры, вызывающих повреждение клеток.
По указанным свойствам лазерная рефлексотерапия ближе к магнитной рефлексотерапии.
К достоинствам лазерной рефлексотерапии относится ее бесконтактное
воздействие на ткани, что полностью исключает их инфицирование, особенно
вирусами гепатита и СПИДа, и в значительной мере упрощает лечебные процедуры.
Нейротропные свойства лазерного света особенно выражены при неврологических
расстройствах - невралгиях тройничного и лицевого нервов, а также при глоссалгиях.
Эффективность лазерной рефлексотерапии в значительной мере повышается при
сочетанном воздействии на точки акупунктуры и местно на патологические
очаги в тканях.
Импульсный режим лазерного света более эффективен по сравнению с непрерывным.
Он более адекватен условиям жизнедеятельности клеток, поскольку обменные
процессы, проницаемость клеточных мембран (оболочек), микропиноцитоз и
другие внутри- и внеклеточные процессы совершаются дискретно, в импульсных
режимах.
Механизмы действия хирургических лазеров (типа лазерного скальпеля).
Применяемые для этих целей высокоинтенсивные (мощностью от 5 до 80 Вт)
лазеры воздействуют на ткани за счет двух факторов: высокой (до 1000 °С)
температуры и давления света. При воздействии тонкого (до 25 мкм) лазерного
луча за счет высокой температуры в зоне его воздействия ткань испаряется
и образуется разрез. Кроме разрезов (рассечения) тканей, с помощью лазерного
скальпеля можно осуществлять фотогидравлическое препарирование, коагуляцию,
сварку и абляцию (возгонка, испарение) тканей.
Фотогидравлическое препарирование проводят в два этапа. Подготовительный
этап заключается в инфильтрации тканей в зоне операции анестетиком по типу
тугого инфильтрата (по А.В. Вишневскому) или изотоническим раствором натрия
хлорида (если операцию проводят под наркозом). Инфильтрируемая жидкость
раздвигает клетки тканей, значительно увеличивая межклеточные пространства.
Затем лазерным лучом проводят разрез ткани. При этом основная энергия (высокая
температура) в ткани расходуется на испарение межклеточной жидкости, возникает
высокое давление паров, которые как бы раздвигают (расслаивают) ткани при
их минимальном повреждении.
В отличие от способа тупого расслоения тканей (только в определенных
направлениях, обусловленных топографоанатомическими образованиями - межфасциальными
и межклеточными пространствами) фотогидравлическое препарирование можно
осуществлять в любых направлениях и на любых мягких тканях.
При воздействии лазерного луча на ткани (рассечение, поверхностная
обработка и т.д.) под влиянием высокой температуры происходит коагуляция
белков крови и тканевой жидкости с образованием плотной коагуляционной
пленки, которая обладает выраженными адгезивными свойствами и является
надежным барьером против патологически измененных (в том числе опухолевых)
клеток, микробных тел и вирусов, а также микробных токсинов, задерживает
испарение жидкости с поверхности кожи, в связи с чем лазеры успешно применяют
при лечении ожогов. При пересечении лазерным лучом кровеносных и лимфатических
сосудов диаметром до 1 мм в артериальной сети и до 1,5 мм в венозной их
просветы как бы завариваются и обеспечивают надежный гемостаз; при этом
хирург работает на практически сухом операционном поле.
Коагуляционная пленка образуется также при обработке лазерным расфокусированным
лучом патологически измененных поверхностей кожи и слизистой оболочки полости
рта, в частности при ожогах, рвано-ушибленных ранах, нагноениях и т.п.
При некротомии методом абляции происходит удаление патологически измененных
тканей. Аналогичным способом удаляют капиллярные гемангиомы.
Сварку тканей (встык или внакладку) осуществляют следующим образом.
Края тканей сближают, удерживая их зажимами, и по линии их смыкания проводят
умеренно расфокусированным лучом лазера. Под воздействием высокой температуры
из краев тканей как бы выжимаются тканевая жидкость и кровь, белки которых
коагулируются и образуют очень прочный шов.
Механизмы противокариозного действия низкоинтенсивных импульсных полупроводниковых
лазеров. Противокариозное действие импульсного лазерного света слагается
из трех основных компонентов: 1) непосредственного воздействия на твердые
ткани зуба, приводящего к снижению проницаемости эмали, усилению реминерализации,
повышению микротвердости; 2) опосредованного воздействия через пульпу зуба,
проявляющегося стимуляцией микроциркуляции и метаболизма, повышением секреторной
деятельности одонтобластов с образованием заместительного дентина; 3) ингибирующего
воздействия лазерного света на микрофлору и ферментные системы зубной бляшки.
Кроме непосредственного местного, лазерный свет оказывает общее (общеукрепляющее)
действие, выражающееся в стимуляции механизмов иммунной защиты организма,
нейрогуморальной и других систем, приводящей к мобилизации общих адаптивных
реакций организма, повышению уровня его гомеостаза, что очень важно при
проведении профилактики кариеса зубов у ослабленных детей, с аллергическим
статусом, авитаминозами, явлениями относительной алиментарной дистрофии
и другими расстройствами.
Механизмы лазерного препарирования твердых тканей зуба. Лазерный импульсный
свет (в основном излучателей на неодиме, активированном эрбием или гольмием,
эксимерных лазеров и др.), воздействующий на твердые ткани зуба, при определенных
параметрах (обычно мощность порядка 2-8 Дж/имп, частотой до 15 Гц) реализуется
за счет двух основных составляющих: абляции эмали под влиянием высокой
температуры и выбивания фотонами частиц фосфорно-кальциевых солей гидроксилапатита
эмали. Как негативное побочное явление следует отметить обугливание эмали
вследствие наличия органического межпризменного вещества, что ведет к образованию
микротрещин, провоцирующих вторичный кариес. Однако современные лазерные
аппараты позволяют избежать этого недостатка.
Механизм действия лазерного света на металлы, керамику, композиты.
При взаимодействии лазерного импульсного света высокой интенсивности (2-10
Дж/имп) с металлами, керамикой, композитами и другими материалами возникает
высокая температура (3000 "С и выше). Под ее влиянием происходит испарение
металла. Таким образом можно осуществлять резание, перфорацию материалов,
а также отжиг, уплотнение и т.д. Менее высокие температуры (1000-2000 °С)
вызывают плавление металлов, керамики и других материалов используются
для их сварки. Можно успешно сваривать разнородные металлы, например сталь
и золото, сталь и кобальтохромовые сплавы и др. Достоинством лазерной сварки
является прочность сварных швов, которая в 2,5 раза выше по сравнению с
таковой паяных. Микротвердость сварных швов на 5-10 % выше микротвердости
основного металла. При сварке с малой длительностью импульсов сохраняются
упругие, эластичные свойства металла, что важно, например, при изготовлении
дуговых ортодонтических аппаратов.
Лазерная профилактика и физиотерапия стоматологических заболеваний охватывают
широкий круг нозологических форм: кариес зубов, пульпиты, периодонтиты,
заболевания пародонта (гингивиты, пародонтиты, пародонтоз) и слизистой
оболочки полости рта (стоматиты - острый герпетический и хронический афтозный,
стоматит. Сеттона, хейлиты, лейкоплакия, красный плоский лишай, многоформная
экссудативная эритема, глосситы, глоссалгии), невралгии тройничного нерва,
фурункулы и карбункулы лица и шеи, травмы (в том числе лучевые, послеоперационные,
переломы костей лица и др.), артриты и артрозы височно-нижнечелюстного
сустава, воспалительные заболевания слюнных желез (паротиты, сиалоадениты),
лимфадениты, альвеолиты, гаймориты и остеомиелиты, актиномикоз и др.
В ортопедической стоматологии лазерный свет применяют для ликвидации
наминов после наложения съемных (включая бюгельные) протезов, воспалительных
явлений краевого пародонта после ретракции десны, а также с целью профилактики
пульпитов при препарировании зубов под цельнолитые и металлокерамические
протезы, в ортодонтии - для предупреждения осложнений и ускорения перемещения
зубов, особенно у лиц старшего возраста.
Лазерную физиотерапию применяют в качестве самостоятельного метода
лечения и в сочетании с другими физическими факторами (магнитные поля,
ультразвук и др.), лекарственными средствами, хирургическими, ортопедическими,
ортодонтическими и другими методами лечения стоматологических заболеваний.
Одной из высокоэффективных модификаций лазерной физиотерапии тяжелых
форм воспалительных гнойно-деструктивных процессов (в том числе одонтогенных)
является воздействие на зоны каротидных синусов. Механизм этого воздействия
слагается из следующих основных компонентов: 1) неинвазивное чрескожное
облучение в единицу времени значительных объемов крови (до 20 л), протекающей
по общей, наружной и внутренней сонным артериям (при внутривенном облучении
за 60-80 мин можно облучить не более 0,25 л крови); 2) лечебное действие
непосредственно в патологических очагах на кровь, которая под влиянием
лазерного света приобретает детоксицирующие свойства; 3) лечебное (в том
числе выраженное нейротропное) действие лазерного света на область каротидного
синуса, которая является мощной рецепторной зоной; 4) высокоэффективные
нейроэндокринные регуляторные функции каротидной железы; 5) иммуннокорригирующее
воздействие; 6) нормализация системы гемостаза. В настоящее время этот
патентованный метод обеспечивает настолько высокую лечебную эффективность,
что его стали успешно применять в гнойной торакальной и абдоминальной хирургии,
гинекологии и др.
Магнитолазерная терапия применяется при лечении указанных выше стоматологических
заболеваний. Она особенно эффективна при выраженных явлениях экссудации
(отеках) тканей (пульпиты, периодонтиты, альвеолиты, синдром Мелькерссона-Ро-зенталя,
одонтогенные воспалительные процессы и т.д.), нарушениях трофики (дистрофический
компонент), трофических язвах и нарушениях регенерации (задержка заживления
ран), корригирующих операциях по иссечению избыточных (в том числе келоидных)
рубцов, костной пластике и т.п.
Лазерная рефлексотерапия, обусловленная выраженным нейротропным действием
лазерного света, наиболее эффективна при лечении невралгий тройничного
и лицевого нервов (у лиц пожилого возраста, длительно страдающих этой патологией,
лазерный свет применяют в комбинации с финлепсином). Противопоказаниями
к лазерной рефлексотерапии являются органические изменения нервных стволов.
Однако после нервэкзереза лазерный свет используют для стимуляции заживления
послеоперационных ран, предотвращения образования неврином и ликвидации
фантомных болей.
Лазерную рефлексотерапию успешно проводят при глоссалгиях, пульпитах,
периодонтитах, пародонтитах, рецидивирующих афтозных стоматитах и других
заболеваниях с выраженным болевым синдромом, а также как самостоятельный
метод обезболивания.
Лазерную физиотерапию обычно проводят в два этапа. На первом этапе
осуществляют противовоспалительное лечение (мощность 2-4 Вт, частота 80-100
Гц, экспозиция 2 мин на поле, 3-6 процедур) до ликвидации явлений воспаления.
На втором этапе показана стимулирующая терапия - разрешение воспаления,
патологических очагов и элементов, стимуляция регенерации (мощность 0,5-2
Вт, частота 2-3 кГц, экспозиция 1-1,5 мин на поле, 5-12 процедур). На лазерном
аппарате "Оптодан" лечебный процесс автоматизирован: эти процедуры осуществляют
соответственно на I и II каналах, при включении которых микропроцессор
автоматически выставляет все необходимые параметры лазерного света.
Применение лазерных хирургических аппаратов (лазерного скальпеля) для
хирургического лечения стоматологических заболеваний. Заболевания пародонта.
При язвенно-некротических и гипертрофических гингивитах с помощью умеренно
расфокусированного лазерного луча методом абляции осуществляют соответственно
некротомию и удаление гипертрофированных тканей краевого пародонта. Образующаяся
при этом коагуляционная пленка обеспечивает защиту тканей от мацерирующего
действия слюны и микрофлоры, а также стимуляцию эпителизации, что сокращает
сроки лечения.
При лоскутных операциях наиболее ответственный этап - деэпи-телизацию
внутренней поверхности пародонтальных карманов - осуществляют умеренно
расфокусированным лазерным лучом, что обеспечивает высокую эффективность
без образования микрогематом и нагноений, исключает склерозирование и рубцевание
лоскута, ретракцию десневого края, обнажение шеек зубов и рецидивы заболевания.
При выраженном воспалении краевого пародонта для ликвидации послеоперационного
(посттравматического) воспаления и стимуляции регенерации тканей применяют
лазерную физиотерапию, используя аппарат "Оптодан".
Заболевания слизистой оболочки полости рта. Метод абляции патологически
измененных тканей и патологических элементов чаще применяют при лечении
хронических, длительно вяло текущих и не поддающихся консервативному лечению
заболеваний слизистой оболочки полости рта, особенно хейлитов, красного
плоского лишая, лейкоплакии, многоформной экссудативной эритемы, хронического
рецидивирующего афтозного стоматита, пузырчатки, актиномикоза и т.п.
Принцип метода абляции предельно прост: удаляют патологический субстрат
(патологически измененные ткани, патологические элементы) и таким образом
радикально устраняют заболевание. При четко выполненной технике рецидивы
практически крайне редки. Лечение осуществляют путем послойной абляции
патологически измененных тканей и патологических элементов слизистой оболочки
рта умеренно расфокусированным пучком в пределах здоровых подлежащих тканей.
Это условие чрезвычайно важно, так как только полное удаление патологически
измененных тканей и патологических элементов исключает рецидивы. От хирурга
требуются четко отработанные навыки и высокое мастерство.
Методом абляции успешно лечат также трофические язвы полости рта (чаще
дна), лучевые поражения и т.д.
Гнойные воспалительные процессы. Такие свойства лазерного луча, как
асептика и антисептика, обусловливают его успешное применение при лечении
фурункулов и карбункулов путем послойной абляции и иссечения некротических
стержней, а также послойной абляции полостей. При нагноившихся атеромах
лазерный луч используют для одномоментной абляции всей опухоли с оболочкой,
что позволяет сократить процесс лечения и исключить рецидивы.
Более высокую эффективность этих манипуляций может обеспечить (в определенной
мере, не зависящей от квалификации хирурга) лазерный хирургический аппарат
нового поколения с компьютерным управлением "Ланцет". Специальные компьютерные
программы автоматически обеспечивают оптимальные параметры лазерного луча
(мощность, длительность импульса, частота их следования, экспозиция) при
различных видах патологии тканей в зависимости от их оптической плотности
и вида патологии.
Абсцессы и флегмоны вскрывают обычным скальпелем или остросфокусированным
лазерным лучом, опорожняют и обрабатывают умеренно расфокусированным лазерным
лучом. Абляция в сочетании с высокой температурой позволяет полностью удалить
гнойные массы, грануляции, некротизированные ткани с последующим наложением
первичного шва. Если имеются глубокие свищевые ходы, затрудняющие обработку
тканей лазерным лучом, то на сутки оставляют в ране дренаж. Такой способ
обеспечивает заживление ран в короткие сроки (по сравнению с общепринятыми
способами лечения) первичным натяжением и без избыточных рубцовых образований.
Гнойные раны и ожоги. Рвано-ушибленные и гноящиеся раны и ожоги (в
том числе химические и радиационные) лечат методом абляции (лазерная некротомия).
После обработки таких травм лазерным лучом на поверхности образуется плотная
коагуляционная пленка, являющаяся надежным барьером против инфекции, а
при ожогах предотвращающая выпот (потерю) жидкости. Такие раны (особенно
при ожогах) можно вести открытым способом. Во избежание подсыхания и растрескивания
коагуляционной пленки ее смазывают масляным раствором цигерола 1:5, официнальной
цигероловой мазью, а также нейтральным маслом (лучше облепиховым, или абрикосовым,
арахисовым и др.). Коагуляционная пленка способствует быстрой эпителизации
раневых поверхностей. Коагуляционная пленка на слизистой оболочке надежно
защищает раневую поверхность от мацерирующего действия и микрофлоры ротовой
жидкости.
Опухоли. Успешное применение лазерного скальпеля при лечении опухолей,
особенно злокачественных, обусловлено его уникальными свойствами абластики
и антибластики. Методики лечения доброкачественных и злокачественных опухолей
с применением лазерного скальпеля имеют общие принципы и в то же время
определенные особенности.
При лечении доброкачественных новообразований (фибромы, папилломы,
невусы и т.д.) и опухолеподобных образований (ретенцион-ные кисты, атеромы)
в зависимости от их размеров и локализации удаляют лазерным лучом двумя
основными способами: небольшие новообразования (диаметром 0,2-1 см) обычно
удаляют методом абляции или лазерокоагуляции (фотокоагуляции), после чего
образуется коагуляционная пленка.
Особенно эффективен лазерный скальпель при удалении гем- и лимфангиом,
а также вмешательствах на слюнных железах. При применении электро- и термокаутеров
и особенно криотерапии возможны вторичные кровотечения и тромбозы сосудов
прилежащих тканей, что грозит тяжелыми осложнениями вплоть до летального
исхода. При использовании лазерного скальпеля эти осложнения полностью
исключены. При операциях на слюнных железах исключаются также такие осложнения,
как образование свищей и кист.
При удалении ретенционных кист значительных размеров для исключения
рецидива их оболочку окрашивают метиленовым синим. Шприцем отсасывают содержимое
кисты, вводят и затем отсасывают 2 % водный раствор метиленового синего.
Затем вскрывают кисту и методом абляции послойно (до исчезновения голубой
окраски) до пределов здоровой ткани удаляют дно оболочки кисты.
Высокие результаты лазерные способы дают при удалении гигантоклеточных
эпулисов, не требующих удаления рядом стоящих зубов и исключающих рецидивы,
а также полиморфно-ядерных аденолим-фом околоушных слюнных желез (обычно
рецидивирующих) за счетнадежного разрушения лазерным лучом точек роста
этих новообразований.
При воспалительной реакции окружающих опухоль тканей перед операцией
целесообразно провести 2-3 процедуры лазерной физиотерапии на лазерном
аппарате "Оптодан" с противовоспалительными параметрами (первый канал),
а после операции повторить их для купирования воспаления и улучшения заживления
раны.
Злокачественные новообразования (базалиомы, плоскоклеточный рак, саркомы,
меланомы), а также очаги рецидивов опухолей после хирургического или лучевого
лечения диаметром до 1 см удаляют под местной анестезией (предпочтительнее
проводниковой) методом лазерокоагуляции в пределах здоровых тканей.
Злокачественные опухоли диаметром свыше 2 см целесообразно удалять
методом иссечения - лазероэксцизии под местной анестезией. При значительных
размерах опухолей и, соответственно, образовавшихся дефектах тканей проводят
их одномоментную пластику путем ушивания "на себя" или замещением местными
тканями, лоскутом на ножке, свободными трансплантатами, по показаниям филатовским
стеблем.
При лазерном лечении меланом перед иссечением опухоли во избежание
метастазов для надежного обеспечения абластики рекомендуется образовать
лазерным лучом 1-2 предохранительных пояса вокруг опухоли. Образующийся
при этом коагуляционный вал исключает возникновение метастазов.
Важным достоинством лазерного скальпеля, особенно в условиях страховой
медицины, является возможность проведения многих операций (которые раньше
делали только в стационаре) в поликлинике на массовом амбулаторном приеме,
что дает существенную экономию средств и времени, а также позволяет сократить
число госпитализируемых больных.
Пластика тканей. Основными достоинствами лазерного скальпеля при пластике
тканей являются исключение образования микрогематом и последующих нагноений,
ускоренное заживление послеоперационных ран, образование косметически малозаметных
рубцов. Например, если после воздействия электро-, термокаутеров или криотерапии
возникают втянутые (ниже уровня поверхности ткани), иногда звездчатые рубцовые
деформации или келоидные рубцы, то после применения лазерного скальпеля,
особенно в импульсном режиме, по компьютерной программе, характеризующейся
минимальной травматизацией тканей, эти осложнения практически исключены.
Эффективным приемом, обеспечивающим минимальную ширину разреза и ровные
края, хорошо заживающие, является предварительное охлаждение по линии намечаемого
разреза кожи струёй хлорэтила. В этом случае при воздействии лазерного
остросфокусированного луча на охлажденную ткань повреждение клеток ткани
в зоне разреза оказывается минимальным.
С помощью лазерного скальпеля с высокой эффективностью производят рассечение
уздечек языка и губ, углубление преддверия полости рта, а при свободной
аутодермопластике изъянов лица - рассечение послеоперационных рубцовых
тяжей, иссечение келоидных рубцов и т.п.
Лазерный скальпель используют при местно-пластических операциях: для
замещения изъянов, образовавшихся после удаления доброкачественных и злокачественных
опухолей, келоидных рубцов, при пластике лоскутом на ножке, треугольными
лоскутами, пластике губ, рино- и блефаропластике, удлинении уздечек губ
и языка, первичной и вторичной ринохеилопластике, ураиопластике и др.
В последние годы лазерный скальпель успешно применяют при хирургическом
лечении огнестрельных ранений челюстно-лицевой области, обработке рвано-ушибленных,
гнойных ран (лазерная иекротомия), ожогов кожи лица, лечении травматического
остеомиелита лицевых костей, травмах слюнных желез и т.д. Для оказания
помощи при челюстно-лицевых ранениях в полевых условиях используют специальную
модификацию лазерного аппарата нового поколения с компьютерным управлением
"Ланцет" в полевой укладке с бортовым электропитанием от автомобильных
аккумуляторов.
Автоматизированные компьютерно-лазерные диагностико-лечебные системы
получают все более широкое распространение. При помощи их врач может проводить
дифференциальную диагностику, определять показания и противопоказания к
лазерной терапии (хирургии), оптимальные параметры и режимы лазерной терапии
с учетом объективного общесоматического и стоматологического статусов конкретного
больного, контролировать и корректировать процесс лечения и, наконец, оценивать
степень излечения (реабилитации). Все эти сложные мероприятия, требующие
большого опыта и высокой квалификации врача, соответствуют уровню коллектива
ведущих специалистов, квалификация которых заложена в компьютерные программы.
Лазерное препарирование твердых тканей зуба. Для препарирования твердых
тканей зуба - эмали и дентина - используют специальные лазерные аппараты
с импульсными излучателями из неодима, активированного эрбием и гольмием,
мощностью 1 - 10 Дж/имп и частотой следования импульсов 3-20 Гц. Первый
лазерный аппарат для препарирования твердых тканей зуба был разработан
в НИИ "Полюс" совместно с ЦНИИС, аппарат "Эрмед" - в ФИАН, другие аналогичные
аппараты - в Оптико-механическом НПП и Институте тонких оптических технологий.
Эти аппараты вполне удовлетворяют требованиям, предъявляемым к препарированию
твердых тканей зуба, в том числе кариозных полостей (с последующим пломбированием
предпочтительно композитными материалами), а также к вскрытию полости зуба,
прохождению и обработке корневых каналов зубов, гемисекции и резекции верхушки
корня зуба (с предварительным подходом к корню через стенку альвеолы также
с помощью лазерного луча). Широкое применение этих аппаратов сдерживает
очень высокая стоимость их при адекватно низком техническом ресурсе излучателей,
которые требуют частой (примерно один раз в месяц) замены, что связано
со значительными расходами (во много раз больше, чем на приобретение и
содержание турбинных бормашин лучших типов).
Лазерные технологии изготовления зубных протезов и ортодонтических
аппаратов. Лазерные технологии используют для изготовления ортопедических
конструкций. Они улучшают качество протезов, исключают применение дорогостоящего
серебросодержащего припоя ПСР-37 (к тому же обладающего токсическими свойствами),
повышают производительность труда, дают существенный экономический эффект.
Лазерную сварку применяют в первую очередь для изготовления мостовидных
протезов с штампованными коронками, а также при изготовлении мостовидных
протезов из КХС и штампованных коронок на жевательные зубы при феномене
Попова-Годона, когда высота коронок не позволяет изготовлять цельнолитую
конструкцию.
При глубоком резцовом перекрытии, когда цельнолитые металлокерамические
протезы мало эффективны и недолговечны, показано изготовление мостовидных
протезов с штампованными коронками и полимерной облицовкой, удерживаемой
специальными ретенционными конструкциями, изготовленными по лазерной технологии
и надежно укрепляющими полимерную облицовку (по сравнению, например, с
окончатыми коронками по Белкину).
Лазерная сварка позволяет при необходимости сваривать ортопедические
конструкции из стали 1Х18П91 и золота, серебряно-палладиевого и других
сплавов (например, никель-алюминиевых, палладиево-индиевых и др.). Большое
распространение получают лазерные технологии изготовления мостовидных протезов
с замковыми креплениями (аттачменами), так как лазерная сварка обеспечивает
точную сборку этих протезов и надежное замковое крепление. Лазерную сварку
используют также при изготовлении бюгельных протезов с металлокерамическими
зубами (обычно фронтальными), при покрытии стальных протезов нитритом титана
(в этих протезах лазерная сварка исключает необходимость нанесения подложки
из никеля или хрома на месте спайки, увеличивает прочность и позволяет
сохранить цвет покрытия в месте сварки). При изготовлении ортопедических
аппаратов, главным образом дуговых, бесприпойная лазерная сверка обеспечивает
их высокие эластические пружинящие свойства, а также исключает токсическое
влияние припоя ПСР-37 (выделение в полость рта вследствие коррозии таких
ингредиентов припоя, как кадмий, бериллий, медь и др., неблагоприятно действующих
на организм детей).
Лазерные технологии применяют также в имплантологии для припасовки
перфорации имплантатов из металлов, сапфира и других материалов, сварки
различных конструкций и т.д.


Физиологические механизмы лечебного применение низкоэнергетического
гелий-неонового лазера
Экспериментальные и клинические наблюдения указывают на благоприятное
терапевтическое действие монохроматического когерентного гелий-неонового
лазерного излучения малой мощности на жизнедеятельность клеток и тканей
животных и человека. Лучи низкоэнергетического лазера, благодаря взаимодействию
с мембранами, органелами и молекулярными структурами клетки, поглощающими
кванты излучения в области спектра 0,6328 мкм, выполняют роль сенсибилизатора
и стимулятора ряда клеточных реакций, направленных на восстановление и
нормализацию биоэнергетического статуса тканей организма.
По мнению Goldman (1983), гелий-неоновое лазерное излучение не обладает
определенной специфичностью воздействия. Многообразие и многофакторность
ответной реакции организма делает это излучение уникальным.
Характер влияния низкоэнергетического лазера на биологическую ткань
зависит от параметров излучения: мощности, длины волны, проникающей способности,
времени и кратности воздействия лучей, пигментации тканей, площади, подвергающейся
воздействию, а также массы биологического объекта. Степень воздействия
пропорциональна плотности мощности излучения и зависит от исходного состояния
организма.
По данным Р.Е. Кавецкого и соавторов (1969), величина плотности мощности
излучения, при которой может произойти повреждение клеток и, в то же время,
проявиться стимулирующие свойства излучения, лежит между 0,8 и 2,5 мВт/см2.
М.Т. Александров и А.А. Прохончуков (1981) сообщают о выраженной стимуляции
пролиферации культуры фибробластов под воздействием гелий-неонового лазера
(ГНЛ) уже при плотности мощности излучения (ПМИ) 1-0,1 мВт/см2. Аналогичные
данные получены А.В. Архангельским и соавторами (1980), А.П. Ракчеевым
и соавторами (1981) и др. Многие экспериментальные и клинические исследования
демонстрируют положительное влияние лазерного воздействия на заживление
ран, трофических язв, на течение воспалительного процесса, блокирование
болевого фактора. Речь идет о лазерах значительно более высокой плотности
мощности: 25, 100 и 200 мВт/см2. Одновременно установлено, что ПМИ порядка
400 мВт/см- угнетает физиологические процессы в тканях.
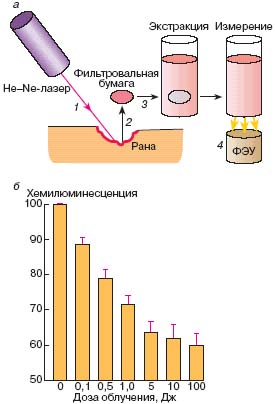
Первые признаки повреждающего действия ГНЛ в дозе более 0,036 Дж обнаружил
Авербах с. сотрудниками в 1977 г. в экспериментах на животных, проводя
микроскопическое исследование раневой поверхности.
Биологический эффект зависит от степени проникновения лазерного излучения
в ткани. По данным литературы проникающая способность лучей лазера прямо
пропорциональна длине волны, а также зависит от пропускающей способности
различных тканей (С.А. Бучнев с соавторами, 1984). Красный свет ГНЛ, имеющий
длину волны 0,6328 мкм, проникает в биологическую ткань лучше, чем излучение
других участков видимого и ультрафиолетового диапазона света (Н.Ф. Гамалея,
1981). По данным В.Ф. Трухина с соавторами (1976) и С.Д. Плетнева (1976),
глубина проникновения гелий-неонового излучения не превышает 2,5 мм. С.М.
Зубкова, И.Г. Лапрун (1981) показали, что через кожу крысы проходит около
50 % лазерной энергии, через кожу и подлежащую мышцу - 33 %, через теменную
кость 61 %. Такой проникающей способностью обладает и некогерентный свет
лампы накаливания, но ГНЛ с длиной волны 0,63 мкм обладает выраженными
терапевтическими свойствами, благодаря не когерентности, а монохроматичности
лазерного лучэ (О. Г. Астафьева, В.В. Гусев, 1983). Нами замечено, (1980),
что значительная часть энергии ГНЛ при ПМИ 6 мВт/см2 проникает через ткани
альвеолярного, отростка нижней челюсти толщиной около 1 см. Это явление
фиксируется на рентгеновской пленке. Впоследствии подобные результаты получены
Г.А. Аскарьяном (1982).
Деуэрти и соавторами (1978), учитывая рассеянную и поглощенную тканями
энергию излучения ГНЛ, установили, что на глубине 20 мм фиксируется около
8 % излучения из всей поглощаемой, что составляет 39-51 % падающей (В.М.
Медведев с соавторами, -1979). По мнению В.Д. Макаренко и соавт. (1984),
воздействие лазерного излучения приводит к повышению проницаемости цитоплазматических
мембран, благодаря чему ускоряются транспортные процессы в тканях. Однако,
лазерное излучение не оказывает существенного влияния на проницаемость
неповрежденных сосудов и слизистой оболочки рта (В.А. Сапрыкин, А.Г. Колесник,
1984).
Механизм действия лазерного излучения на живой организм еще полностью
не расшифрован. По мнению Goldman (1983), особый терапевтический эффект
лазерного излучения низкоэнергетического уровня сомнителен. Действительно,
благотворное действие низкоэнергетического лазера реализуется посредством
ряда уже известных физических и биологических процессов.
Биофизические исследования и анализ литературных материалов позволили
Н.Д. Девяткову, С.М. Зубковой, И.Б. Лапрун и Н.С. Макеевой (1987) сформулировать
принципы воздействия лазерного излучения на биологические ткани. В основе
биостимулирующего действия низкоэнергетического лазерного излучения лежит
структурно-функциональная перестройка мембранных образований клетки и внутриклеточных
органел. Показана возможность распределения поглощаемой энергии лазера
между атомными группировками молекул, находящихся в колебательно-возбужденном
состоянии. Экспериментально доказано участие мембранных структур клетки
в формировании ответной реакции на световое возбуждение:
от мембраносвязанного акцептора через аденоциклазную систему к усилению
биоэнергетических и биосинтетических процессов (А. Поликар, 1975;
А.Г. Кац, Н.С. Макеева, 1987).
Воздействие низкоэнергетического лазерного излучения на биологические
ткани (вещества) и структуры осуществляется через ряд фотохимических и
фотобиологических процессов. Фотобиологические процессы осуществляются
в 3 этапа: поглощение кванта света, включение фотохимических реакций, образование
фотопродуктов (фотобиологического эффекта). Взаимодействие лазерного излучения
с биртканью происходит при совпадении той или иной длины волны излучения
и соответствующего биологического субстрата - акцептора лазерной энергии.
Важнейшим из них является фермент каталаза, адсорбирующий излучение гелий-неонового
лазера с длиной волны 0,63 мкм (Н.Д. Девятков, С.М. Зубкова с соавторами,
1987).
Каталазная активность восстанавливается при действии гелий-неонового
лазера плотностью Мощности (ПМИ) 1-2,5 мВт/см2 и экспозицией от 15 сек
до 30 мин. Активность фермента каталазы повышается за счет конформационного
изменения ее активного центра. Также выявлены конформационные изменения
в мембранах митохондрий.
Низкоинтенсивное лазерное излучение обладает активным действием на
иммунокомпетентные системы как in vitro, так и in vivo в диапазоне плотности
мощности от 0,25-10 мВт/см2 и экспозиции 5 и 10 мин. При этом наблюдалось
уменьшение выработки серотонина и гистамина, ингибирование холинэнергических
систем и феномена Артюса, а также развитие биостимулирующих процессов в
аллергически зависимых очагах повреждения (А.П. Ракчеев с соавторами, 1981;
Н.И. Трапезников с соавторами, 1984; В.Н. Шабалин с соавторами, 1989; О.Г.
Бабаев с соавторами, 1989 и др.). Имеются однако данные, что при плотности
мощности излучения ниже 1 мВт/см2 и экспозиции 10 мин лазерное облучение
не изменяет параметры иммунологической системы здоровых людей (Н.Д. Гладков
с соавторами, 1984).
Если применение лазерных источников большой мощности может привести
к непоправимым изменениям генетического аппарата клетки (Bens с соавторами,
1979), то воздействие низкоэнергетического гелий-неонового лазера вызывает
у экспериментальных животных достоверно обратимые изменения в виде стимуляции
митотической активности, снижения содержания полового хроматина в эпителиальных
клетках слизистой оболочки рта, лимфоцитах костного мозга и др. (И.Р. Бириляк,
И.В. Лопушан, 1981;
Е.Н. Мешалкин с соавторами, 1982; Г.С. Чукмай, М.А. Бордовский, 1984).
С помощью реографии слизистой оболочки рта М.Т. Александров, В.П. Зайцева,
Н.К. Логинова (1976); М.Т. Александров, А.А. Прохончуков (1981) установили,
что при облучении гелий-неоновым лазером плотностью мощности 100-200 мВт/см2
наблюдается вазомоторный эффект:
в момент воздействия интенсивность кровоснабжения возрастает на 3-20
%, затем в течение 600 мин она снижается в 2-3 раза. Этот феномен был с
успехом использован в клинике для контроля эффективности лечения синдрома
Мелькерсона-Розеиталя, сопровождающегося отеком губы (Р.А. Байкова, М.Т.
Александров с соавторами, 1979).
По нашим данным, с помощью реографа РПГ-203 при использовании гелий-неонового
лазера более низкой интенсивности обнаружено индивидуальное колебание объемной
скорости кровотока (ОСК) у здоровых людей, которая зависела от функционального
состояния организма и возраста человека (1988). В результате воздействия
лазерного света при плотности мощности излучения 0,5 мВт/см2 на протяжении
2 или 10 мин в тканях чаще преобладали сосудосуживающие процессы, которые
приводили к снижению кровотока. При экспозиции 5 мин преобладали вазодилатационные
процессы, в результате чего ОСК волнообразно возрастала и достигала через
24-48 часов 150--300 % исходного уровня.
Подобные результаты при идентичных параметрах лазерного воздействия
получили В.М. Ковалев, З.Ф. Кривенко (1989); А.А. Шортанбаев (1977); В.И.
Кравцов, Ш.Б. Садыков (1989); А.С. Пиликин, B.C. Барковский (1984); В.М.
Андреева, А.А. Мненков (1980). В экспериментах на животных А.С. Пиликин
и B.C. Барковский с помощью витальной микроскопии и фоторегистрации наблюдали
при плотности мощности 220 мВт/см2 увеличение числа функционирующих капилляров,
что приводило к ускорению кровотока и нормализации микроциркуляции.
Лазерное воздействие малой мощности влияет на активность различных
ферментов (И.Я. Шахмейстер с соавторами, 1974; А.П. Саркисян, 1979;
А.Л. Гуща с соавторами, 1979; Л.Б. Рахальский с соавторами, 1984;
Ю.Д. Березин и др., 1984; Ю.Ц. Немков и др., 1989; А.А. Беляков, И.С.
Каптанский и др., 1984). Однако, эти изменения неоднозначны. Так, М.М.
Седых с соавторами (1980) показали, что активность щелочной фосфатазы находится
в обратной зависимости от мощности излучения и режима воздействия. Например,
однократное облучение (ПМИ 1т-2,5 мВт/см2, экспозиция 5-15 мин) вызывает
возрастание протеолитической активности ЩФ раневого отделяемого, а 2-3-х
кратное - ее снижение (В.Г. Бик, 1984).
Изменение кровотока и активности ферментообмена приводит к трофическим
сдвигам в тканях и отдельных клетках. Повышение утилизации кислорода под
влиянием ГНЛ способствует уменьшению гипоксии, наблюдающейся при воспалении,
ускорению роста капилляров и фибробластов, накоплению продуцируемого ими
коллагена, от которого зависит активность эпителизации раневой или язвенной
поверхности (А.В. Архангельский и др.. 1978, В.Н. Кошелев, 1980; B.C. Усик,
1984).
Под действием низкоэнергетического лазерного излучения снижается биологическая
и биоэлектрическая активность рецепторов кожи и повышается порог болевой
чувствительности облучаемой ткани и всего организма (В.А. Безбородов, О.В.
Тарасов, 1978).
Низкая энергия светового потока гелий-неонового лазера оказывает существенное
влияние на регулирование метаболических и катаболических процессов в очагах
поражения путем преобразования в энергию фосфатных связей АТФ митохондрий
посредством усиления пероксидантнои активности каталазы, окислительного
фосфорилирования и повышения энергизации митохондриЙ- важнейших клеточных
структур (В.В. Вашук, 1977; С.М. Зубкова и др., 1978).
Под влиянием лазерного воздействия изменяется клеточный состав в области
раны или трофической язвы, главным образом, за счет увеличения количества
нейтрофилов (И.Т. Ковинскии с соавторами, 1974);
также повышается функциональная активность клеток. Однако, при этом
происходит не простое усиление и ускорение заживления, а нормализация всех
физиологических процессов в клетке и тканях. В то же время, стало известно,
что гелий-неоновое лазерное излучение низкой энергии не оказывает прямого
бактерицидного и бактериостатического действия на микрофлору раны при плотности
мощности излучения до 20 мВт/см2 и экспозиции до 5 часов (А.П. Ракчеев
с соавторами, 1981).
Стимуляция лазерным светом регенеративных процессов при патологических
состояниях (травма, трансплантация) замечена многими авторами (М.М. Авербах
с соавторами, 1977; Н.В. Гормпинко, 1975; И.Г. Дудкевич и А.П. Саркисян,
1980; В.К. Гостищев с соавторами и др., 1985). При этом также активизируются
гормональные (адреналин) и медиаторные (норадреналин) звенья общего адаптационного
механизма организма (В.Н. Кошелев с соавторами, 1980). Излучение низкоинтенсивного
лазера стимулирует защитные силы организма, воздействуя на различные физиологические
свойства клеток и тканей, вызывая непродолжительное торможение или усиление
функции, а затем продолжительное и стойкое ее повышение или, наоборот,
снижение (М.Т. Александр с соавторами, 1976; Д.Л. Корытный, 1978; А.Г.
Кац, В.И. Заусаев, 1984).
Повышение неспецифического иммунитета организма, наблюдаемое после
применения низкоэнергетического лазера, демонстрируется ростом титра гемаглютинина,
гемолизинов, лизоцима, активацией метаболизма нейтрофилов и интерферона,
повышением синтеза иммуноглобулинов, изменением функции и структуры плазматических
мембран лимфоцитов, увеличением числа молодых и бластных форм лимфоцитов
(Л.А. Бутко, М.А. Савченкова, 1984; Н.Н. Трапезников и др., 1984; В.И.
Купин и др., 1984;
Л.П. Титов и др., 1984; П.Д. Герус, В.А. Яковлева, 1987; И.Л. Кручинина,
Ф.Ф. Пекли и др., 1989; С.А. Плехановская и др., 1989; Н.Д. Гладкова, Е.Д.
Пятова, 1989).
Важная информация получена после прямого низкоэнергетического лазерного
облучения циркулирующей крови с помощью гибкого световода, введенного в
венозное русло (Е.Н. Мешалкин, 1981; B.C. Земсков, Н.Ф. Гамалея и др.,
1984; Е.Е. Литасова и др., 1986). Значение внутрисосудистой лазерной терапии
еще больше возрастает в связи с открытием роли эритроцитов, интенсивно
поглощающих лазерный свет, в иммунологическом статусе человека.
Однако, несмотря на бесспорную эффективность этого вида терапии, необходимость
венапункции сдерживает его развитие и применение особенно в амбулаторной
практике. Делаются попытки, и довольно успешные, достигнуть таких же результатов
внесосудистым облучением крови (А.Г. Кац, И. Васькова, 1988; В.В. Коржова
и др., 1989; Ю.Н. Чередниченко, М.В. Бугаев, 1989). В нашей клинике методом
внесосудистой лазеротерапии получены хорошие результаты в лечении острого
остеомиелита челюсти, острого гнойного паротита и синдрома Шегрена (1988).
Заслуживает внимания предложенная Г-Н. Окуневым и З.Н. Тетериной (1981)
методика лечения больных в состоянии тяжелой интоксикации лазерным облучением
крови вне организма и введением вновь ее (реинфузия) по типу аутогемотерапии
(Ю.В. Попов с соавторами, 1989).
Полученные к настоящему времени данные свидетельствуют о том, что лучи
гелий-неонового лазера малой мощности (1-3 мВт/см2) вызывают изменения
различных функций клетки лишь в пределах ее физиологических возможностей,
снижая отрицательное влияние патологического процесса за счет повышения
активности защитно-приспособительных комплексов. "Излучение в указанных
параметрах не вызывает необратимых сдвигов в Организме животного и человека.
Применение более высоких плотностей мощности излучения вплоть до 600-"900
мВт/см2 целесообразно лишь на очень малых площадях (0,004 мкм) воздействия
и большой массе объекта. При этом наблюдается тот же эффект, что и при
действии излучения небольшой плотности мощности на поверхность значительно
большей площади (С.М, Зубкова, Н.С. Макеева, 1987; А.Г. Кац, Н.С. Макеева,
1990). Это явление объясняется тем, что образующееся тепло при высокой
ПМИ отводится большой массой тела.
Диапазон применения низкоэнергетического лазерного излучения очень
широк. Воздействия излучения больной, как правило, не ощущает, переносит
его хорошо. После лазерной терапии больные нередко отмечают прилив бодрости,
повышение настроения.
Лечебный эффект низкоэнергетического гелий-неонового лазера реализуется
на клеточном уровне различными путями (Н.Ф. Гамалея и др., 1983; В.А. Архипенко
и др., 1982; С.М. Зубкова, И.В. Лапрун, 1981). Благодаря способности малых
доз излучения вызывать повышение в тканях количества нейрогормонов, возможно
вовлечение в процесс многочисленных и разнообразных специфических белков
ионных канальцев клеточных мембран, вызывающих активизацию ферментов типа
аденоциклазы, аденилатциклазы, денилциклазы, фосфодиэстеразы, а также ионов
кальция, изменяющих внутри - и внеклеточный метаболизм. Возможно одновременное
воздействие на чувствительные элементы межклеточных пространств (А.Г. Кац
с соавторами, 1984) что приводит, в конечном итоге, к нормализации местной
и общей физиологической реакции, направленной на сохранение (восстановление)
гомеостаза и адаптации организма к изменившимся условиям. Таким образом
можно предположить, что при увеличении времени воздействия увеличивается
число клеток, на которые действует -излучение.
Общеизвестно, что эффективность лечения зависит от стадии и фазы заболевания.
Особенно это касается воспалительных процессов, при которых одинаковые
параметры лазерного излучения вызывают не всегда предсказуемые результаты.
Возможно затухание, обострение процесса или отсутствие изменений в течении
заболевания (Т.К. Сапиев, Н.И. Шурина, 1982).'Следовательно, выбор параметров
излучения представляет собой задачу большой важности.
Взгляды большинства исследователей на длительность воздействия гелий-неонового
лазера низкой интенсивности не совпадают. Так В.А. Мостовиков с соавторами
(1989) считают, что эффективность лазерного воздействия не зависит от его
продолжительности в диапазоне от 20 секунд до 15 минут. Напротив, Д.Л.
Корытный (1981) подчеркивает, что максимальный стимулирующий эффект достигается
при продолжительности облучения от 30 секунд до 3 минут (ПМИ 10-30 мВт/см2).
В.М. Черток с соавторами (1989) наблюдал благоприятное действие лазерного
облучения экспозицией 3-5 мин: повышение активности окислительных процессов
в клетках, нарастание профильного поля ферментов и увеличение числа оксифильных
гранул. При увеличении экспозиции, особенно более 60 мин, тканевые базофилы
постепенно исчезают, что благоприятно сказывается на местном иммунитете.
К этому выводу пришли М.М. Авербах с соавторами (1977). Л.А. Мозговая с
соавторами (1982) считает, что неблагоприятные изменения в тканях возникают
не столько при увеличении интенсивности лазерного низкоэнергетического
излучения (более 100 мВт/см2), сколько от увеличения продолжительности
облучения. Прямо противоположного мнения придерживается Г-Н. Андреев (1989);
полагают, что эффективность действия лазерного излучения прямо пропорциональна
времени облучения, правда, в пределах 5-15 минут и более низкой ПМИ. Большинство
же авторов приходят к выводу, что наиболее оптимальная продолжительность
воздействия низкоэнергетического лазерного излучения лежит в пределах 4-6
минут, при которой противовоспалительные, обезболивающие, стимулирующие,
иммунокоррегирующие свойства гелий-неонового лазерного излучения проявляются
в наибольшей степени (М.М. Авербах с соавторами, 1976; Л.В. Тимошенко,
И.В. Лопушан и др., 1985).
Исключительно важное значение имеет режим воздействия, а также продолжительность
курса лазерного лечения. При однократном облучении стимулирующий эффект
наблюдается до 4 суток. При многократном облучения до 7-8 суток. Однако,
курс -более 10 сеансов не вызывает дальнейших изменений в тканях, клетках
и в организме. Следовательно, длительное воздействие лазера нецелесообразно,
т. к. уже на 17 сутки непосредственные сдвиги в биологическом объекте не
обнаруживаются. Через 10 суток после окончания курса лазерного облучения
ткань вновь становится чувствительной к данному излучению. Таким образом,
положительный результат можно получить при многократном, дробном облучении
с небольшим 0,5-1 минутным интервалом или ежедневно с нарастающей до 15
мин экспозицией при плотности мощности 1-2,5 мВт/см2 (Л.Л. Миронова с соавторами,
1975; Т.Т. Мельдеханов, 1977; Б.М. Хромов с соавторами, 1979; Г.М. Цветкова
с соавторами, 1984; Л.Б. Рахальскнй с соавторами, 1984; B.C. Брик, 1984;
Н.Н. Кишкарева с соавторами, 1989;
А.Г. Кац, 1988 и др.).
При использовании лазера в терапевтических целях возникают большие
сложности в выборе и сочетании параметров излучения, а также их соответствии
особенностям патологии. Как показывает опыт, важную роль играют не столько
физические свойства когерентного излучения, вызывающего биологические сдвиги
в облученных клетках и системах, сколько, в большей степени, функциональная
реакция всего организма на действие лазерной энергии, которая в ряде случаев
может вызвать неожиданные и даже нежелательные последствия. В настоящее
время оптимальные лечебные дозы лазерной терапии не разработаны. Большинство
исследователей и практических врачей в клинической практике используют
свойства лазерного света, положительно зарекомендовавшие себя в экспериментальных
условиях (В.В. Стежко, 1981; М.Т. Александров, Л.Д. Аразашвили, 1984 и
др.). В основу определения терапевтической дозы лазерного воздействия предлагают
положить площадь объекта облучения, степень отражения лазерного света покровными
тканями или степень проникновения лучей в сочетании с плотностью мощности
излучения и мощностью оптического квантового генератора, по которым исчисляется
экспозиция и т. д. Е.И. Брехов, В.И. Брыков, А.И. Полонский, А.В. Черкасов
(1984) считают необходимым учитывать коэффициент поглощения лазерной энергии.
За коэффициент поглощения принята величина, обратная отражению. По усредненным
данным этих авторов, полученным при обследовании различных возрастных групп
населения при воздействии гелий-неоновым лазером плотностью мощности излучения
10 мВт/см2 и длине волны 0,63 мкм, величина отражения кожи лица находится
в пределах от 36,5 % в 17-25 лет и до 28,0 % после 60 лет. Эти показатели
сходны с данными, публикуемыми С.М. Зубковой и И.Б. Лапрун (1981), которые
в экспериментах на крысах с помощью "солнечной батареи" установили, что
величина пропускания лазерного света через кожу и мышцы равна 33 % при
плотности мощности излучения 3-5 мВт/см2. По нашим совместно с М.Т. Александровым
данным при плотности мощности излучения 100-150 мВт/см2 величина отражения
кожи человека в околоушно-жевательной области составила 38-42 %. Однако
нет уверенности, что суммарная интегрированная формула, составленная из
слагаемых селективных показателей действия разных параметров лазерного
излучения, различные комбинации мощности, времени, площади и т. д., может
вызвать предсказуемый физиологический ответ.
Учитывая изложенное, мы предложили определять дозу лазерного светолечения,
которая была бы ориентирована на изменения местного кровообращения в ответ
на воздействие излучения с минимальными исходными данными плотности мощности,
площади поверхности облучения, времени воздействия и состояния тканей и
организма в целом. Эта доза фактически является пороговой. Для ее расчета
учитывали постоянную плотнрсть мощности излучения (0,5-1,2 мВт) при площади
облучения 1 см', экспериментально полученную экспозицию, которая при данных
плотности мощности излучения и площади воздействия обеспечивает на протяжении
суток преимущественное уменьшение кровотока (экспозиция 1-2 мин) или его
усиление (экспозиция 5-6 мин). Облучение в течение 10 мин при указанной
плотности мощности не дает выраженного сосудосуживающего или сосудорасширяющего
эффекта. Поэтому, данная экспозиция, равная 10 мин, применяется с целью
увеличения вероятности взаимодействия большего числа клеток и молекул биообъекта
с лазерным излучением.
Учитывая, что в процессе лечения меняются его задачи, следует соответственно
этому изменять пороговую дозу излучения.
Так как объемная скорость кровотока (ОСК) и ее потенциально возможные
изменения весьма индивидуальны (А.Г. Кац, Т.Г. Робустова, Л.В. Вавилина,
1987), в формулу расчета пороговой дозы вводится индексация по отношению
к нормальной объемной скорости кровотока в участках поражения. В случае
нормальной или незначительно сниженной ОСК индекс равен 1, при ОСК ниже
нормы индекс равен 2, если ОСК выше нормы, то индекс равен 2~1, или, если
значительно выше нормы, то индекс будет равен 3~1. Объемную скорость кровотока
определяют натощак с помощью реографа (Н.К. Логинова с соавторами, 1981)
в мл/мин на 100 г веса ткани. Электроды накладывают по обе стороны объекта.
После трех измерений определяют средний показатель ОСК, который указывает
на уровень регионарной объемной скорости кровотока на данный период болезни.
Сравнивая полученные данные с таковыми у здоровых людей, выбирают в зависимости
от болезни необходимый индекс.
С целью контроля степени эффективности выбора дозы лазерного излучения,
после определения уровня ОСК пространство между электродами однократно
подвергают действию этого излучения и повторно измеряют ОСК. Для индивидуального
подбора дозы ЛТ облучение начинают с минимальной экспозицией- 1-2 мин.
Повторный замер ОСК производят также натощак через 24 часа после облучения.
Расчет интегральной дозы лазерного лечения (ДЛТ) производят по формуле:
ДЛТ = (W*t/S)*I, где W - мощность лазерного излучения в Вт; t - экспозиция
облучения в сек; S - площадь, подвергающаяся .облучению в см2; I - индекс.
Ннзкоэнергетическая лазерная терапия осуществляется отечественными
лазерными аппаратами ЛТМ-01, УЛФ-1 и др., разработанными и апробированными
в области стоматологии в клинике на кафедре пропедевтики хирургической
стоматологии Московского медицинского стоматологического института (А.Г.
Кац, В.И. Заусаев, Н.С. Макеева,-1984).
Показания к применению низкоэнергетического гелий-неонового лазера
Низкоэнергетическая лазерная терапия может быть рекомендована в следующих
случаях.
1. Для ускорения заживления ран после оперативных вмешательств, вскрытия
абсцесса, флегмоны; остеомиелита, альвеолита, пародонтита и др.
2. Для нормализации сращивания костных отломков при переломе челюстей.
3. Для ускорения заживления герпетических высыпаний на коже лица и
слизистой оболочке губ, рта, заживления язв - трофических, .травматических,
при остром и хроническом стоматите, гингивите, а также при красном плоском
лишае,
4. Для заращения свищей и свищевых ходовпри повреждении слюнной железы,
дна верхнечелюстной пазухи.
5. Для рассасывания воспалительного инфильтрата, при серозном лимфадените,
гингивите, после вскрытия периостита, пломбирования канала корня зуба,
обработки зубрдесневых карманов, а также при сиаладените, слюннокаменной
болезни И др.
6. Для устранения идиопатической боли, а также боли, возникающей в
очаге воспаления и ране.
7. Для лечения артрита и артроза височно-нижнечелюстного сустава, а
также болевой дисфункции этого сочленения.
8. Для лечения неврита и невралгии периферических ветвей тройничного
нерва, глоссалгии, пареза лицевого нерва, последствий опоясывающего лишай
и восстановления проводимости поврежденного нерва.
9. Для усиления слюно- и слезообразования при ксеростомии, ксерофтальмии,
синдроме (болезни) Шегрена, а также для восстановления сиалографической
структуры слюнной железы при хроническом сиаладените.
10. Для предоперационной подготовки тканей к пластическим операциям
на лице, челюстях, альвеолярном отростке и профилактики осложнений.
Лазерная терапия может применяться самостоятельно или в комплексе с
другими физическими методами лечения иглотерапией, электросном и др.
Показания к применению низкоэнергетического гелий-неонового лазера ЛТМ-01
1. Опухолевые заболевания в области головы и шеи.
2. Предопухолевые состояния в области объекта лазерного воздействия.
3. Заболевания крови.
4. Инфильтрат, окружающий гнойный очаг до вскрытия и эвакуации гноя,
в том числе при остеомиелите челюсти.
5. Гипертоническая болезнь III стадии; гипотония в период декомпенсации.
6. Туберкулезная интоксикация, активная форма туберкулеза.
7. Острые инфекционные заболевания,
8. Состояние возбуждения нервной системы.
9. Ранние сроки беременности.
Меры защита в процессе лазерной терапии аппаратом ЛТМ-01
В соответствии со стандартом лазерная установка ЛТМ-01 (квантовый генератор
ОКТ-13) относится к лазерным апаратам нулевого ранга, первого класса защиты,
которые не могут создавать опасных уровней облучения. Кроме того, они снабжены
защитными устройствами, исключающими распространение излучения в непредусмотренных
направлениях (В.П. Жохов с соавторами, 1982; Е.В. Кортуков, В.А. Кашуба,
Ю.К. Павлов, 1987 "Гигиеническая классификация труда" Минздрав СССР, №
4117-86). Во время работы с низкоэнергетическим гелий-неоновым лазером
отраженное излучение, как правило, имеет уровень ниже ПДУ (Е.В. Кортуков,
В.А. Кашуба, Ю.К. Павлов, 1987). Работа медперсонала с ЛТМ-01 допустима
в течение всего рабочего дня (8 часов). Миниатюрные, переносные лазеротерапевтические
установки на основе полупроводниковых и гелий-неоновых лазеров, конструкция
которых исключает воздействие на медперсонал лазерного излучения- и сопутствующих
вредных факторов, могут без особых ограничений применяться в кабинетах
врачей, палатах, при посещениях на дому, монтироваться на стоматологических
установках и т. д. (Е.В. Кортуков с соавторами, 1987). Данный генератор
когерентного излучения работает в видимом спектре и может привести к зрительному
дискомфорту (Л.А. Севастьянова, 1966; Я. Чепинскене с соавторами, 1980).
Однако, функциональное состояние системы гипоталамус- гипофиз-кора надпочечника
не нарушается при использовании плотности мощности излучения 4,25 и 40
мВт/см2 и экспозиции 5 и 10 минут (М.М. Никитина, А.Н. Маслакова, 1977;
Н.Е. Думброва, 1985). Критическая пороговая плотность энергии для сетчатки
и роговицы глаза составляет по данным Greeraets, 1960, 1965 5 • l0~7 -5
• 10~6 Дж/см2, т. е. 0,005 мВт/см2 в секунду или 0,3 мВт/см2 в минуту.
Поэтому рекомендуется принять меры, предотвращающие засветку глаз. Этого
можно достигнуть адаптацией органов зрения больного и медперсонала к яркому
свету; пребыванием в хорошо освещенном помещении в течение 15-20 минут
до процедуры и надеванием во время процедуры светозащитных очков. Медперсонал
должен находиться на диспансерном учете у офтальмолога и невропатолога.
Клиническое применение лазерного излучения
1. Этапы лазерной терапии
Лечение больных с помощью, установки ЛТМ-01 должно производиться специалистами
в стационаре или поликлинике (здравпункте). Оно предусматривает подготовку
больного к лечению, назначение и проведение лазеротерапии, до и послепроцедурное
наблюдение.
До проведения лазерного лечения больной должен отдыхать 15- 20 минут
в хорошо освещенном помещении. При -необходимости, у больных с лабильными
нейрососудистыми реакциями до и после процедуры измеряют кровяное давление,
определяют частоту пульса. Больного усаживают или укладывают в стоматологическое
кресло. С помощью оптической насадки устанавливают размер лазерного пятна,
площадь которого соответствует величине плотности мощности излучения; с
увеличением площади пятна уменьшают плотность мощности излучения на каждую
единицу площади. Так, если диаметр лазерного пятна равен 1 см, то вычисленная
по формуле пД2/4 (где Д- диаметр пятна, п- отношение длины
окружности к диаметру =3,14) площадь пятна будет равна 0,8 см2. Выходная
мощность аппарата ЛТМ-01 находится в пределах 1 ± 0,2 мВт, значит плотность
мощности излучения (ПМИ) на облучаемой поверхности будет равна 1,3-1,5
мВт/см2. Расчеты плотности мощности для данного лазерного аппарата прилагаются.
Если ПМИ недостаточна для лечения данного заболевания, то следует установить
необходимую величину уменьшением площади пятна. Кроме использования оптической
насадки, изменение размеров пятна можно произвести перемещением аппарата
по отношению к объекту. Изменение площади пятна прямо пропорционально квадрату
расстояния от источника лазерного света. При значительных размерах поверхности
повреждения на него можно воздействовать последовательно, разделив площадь
поверхности на 2 или 3 участка.
Для отсчета времени воздействия излучения ГНЛ используют физиотерапевтические
часы со звуковым или световым сигналом.
Расфокусированный пучок лазерного света направляют на' объект воздействия,
желательно под прямым углом, когда величина отраженной энергии минимальная,
устанавливают необходимый размер пятна, соответствующий избранной ПМИ и
включают реле времени. Во время проведения процедуры лазерного лечения
с помощью индикатора мощности контролируют ПМИ на облучаемой поверхности.
Правила поведения больного до, во время и после лазерного лечения прилагаются.
По окончании процедуры больному следует отдохнуть 10-15 минут в отведенном
для этого месте.
2. Методика проведения лазерной терапии
В определении тактики лазерного лечения больных с различными заболеваниями
необходимо учитывать специфические особенности каждого из них и принимать
во внимание следующие особенности лазеротерапии.
Лазерное лечение проводится курсами, каждый из которых состоит из нескольких
процедур. В большинстве случаев назначают 6-10 процедур. Если болезнь сопровождается
глубокими органическими изменениями в тканях (рубцы, контрактуры и др.),
количество сеансов можно увеличить до 15-30. В случае быстрого наступления
положительного лечебного эффекта, число процедур может быть уменьшено до
2-4. При длительных хронических заболеваниях, когда другие известные методы
лечения практически неэффективны, производят повторные курсы лечения с
перерывом между ними от 2-3 недель до 3-6 месяцев. Целесообразно назначать
поддерживающие курсы лечения еще до появления признаков рецидива болезни.
Лазерное воздействие (облучение) проводится обычно расфокусированным
пучком; в случаях локализации объекта в труднодоступных участках, полостях,
глубоких ранах используют гибкий волоконный световод. Следует однако помнить,
что при этом теряется важное свойство лазерного излучения - когерентность.
Как показали исследования многих авторов и наши собственные, можно
выделить, с определенной мерой допущения, следующие пределы лазерного терапевтического
действия:
При ПМИ 0,1-0,5 мВт/см2 и экспозиции 1-3 мин достигается биохимическая
и фотохимическая стимуляция клеточного обмена, приводящая к нормализации
функции клетки, -уменьшению объема скорости кровотока ОСК), снятию отека
и повышению порога чувствительности тканей, уменьшению или ликвидации боли.
При ПМИ 0,8-5 мВт/см2 и экспозиции 5-6 мин повышается ОСК, усиливаются
процессы репаративной регенерации, становится более выраженным противовоспалительное,
десенсибилизирующее действие низкоэнергетического ГНЛ излучения, рассасываются
инфильтраты, усиливается дегидратация раны, происходит отторжение некторических
масс, пролиферация грануляционной ткани и покровного эпителия, усиливается
функция секреторных органов.
При ПМИ 2-2,5 - 14 мВт/см2 и экспозиции 10-20 мин поддерживается умеренная
ОСК, наблюдается стойкий обезболивающий и противовоспалительный эффект
при хроническом воспалении, рассасываются рубцы и избыточно образовавшаяся
костная ткань. Таким образом, обезболивающий эффект наблюдается в большей
или меньшей степени при всех указанных режимах.
3. Методика лазеротерапии больных с флегмоной, абсцессом и гнойными
ранами
Одонтогенная флегмона челюстно-лицевой области - своеобразное гнойно-некротическое
воспаление многих клетчаточных пространств и прилежащих тканей, развивающееся
на фоне сенсибилизации организма и обладающее необычайной тенденцией к
распространению.
Излучение ГНЛ малой мощности применяют после вскрытия всех гнойных
очагов. Оно направлено на десенсибилизацию организма, уменьшение и ликвидацию
боли и воспалительных изменений в тканях, снижение влияния интоксикации
продуктами распада микроорганизмов и тканей, а также на стимуляцию процессов
очищения и репаративной регенерации раны. Способностью инактивировать микрофлору
при непосредственном воздействии подобные лазеры не обладают. Однако, наблюдается
повышение бактерицидных свойств крови, фагоцитарной активности нейтрофилов.
Применяют ЛТ начиная с первой перевязки после эвакуации гнойных масс методом
промывания или аспирации раны. Она ^состоит из 2 частей: облучения раны
и облучения флегмонозного инфильтрата.
Пучок ГНЛ направляют под прямым углом на рану или отдельные ее участки.
Доза ЛТ равна 0,14-0,23 Дж/см2 (для одной процедуры), при этом применяют
оптимальную плотность мощности излучения на один •участок, равную. 0,8
мВт/см2-1,3 мВт/см2. Продолжительность облучения одного участка 3 мин.
Диаметр пятна 10 мм. При этом учитывается, что лазерный свет рассеивается
в тканях во всех направлениях. Операционную рану длиною 60 мм делят на
2 участка. Суммарная доза на курс лечения до наложения швов 1,3-1,8 Дж/см2
на один участок инфильтрата. Если используемые световоды подвергнуты антибактериальной
обработке, то они могут быть введены глубоко, в полость раны. Разовая доза
ЛТ может быть равна 0,27-4,5 Дж/см2 Плотность мощности излучения составляет
11-19 мВт/см2.
Продолжительность процедуры - 4 мин ежедневно. На курс лечения - 4-7
процедур. Суммарная доза -1,6-22,3 Дж/см2. После облучения раны и введения
дренажей ГНЛ излучение направляют на более плотные участки инфильтрата,
окружающего рану. Продолжительность облучения инфильтрата в первые сутки
после операции должна быть не более 2 мин, затем ее ежедневно увеличивают
на 1-2 мин, доводя до 6-8 мин, продолжая облучение и после наложения вторичных
швов, до ликвидации воспалительной припухлости. Суммарное время воздействия
в зависимости от размера инфильтрата составляет 8-24 мин. На курс лечения
- 4-8 процедур.
4. Методика лазеротерапии больных с альвеолитом (луночиной болью).
Альвеолит (луночная боль, "сухая лунка") - воспалительное заболевание
раны после удаления зуба, сопровождающееся резкой болью в области челюсти
и нарушением процессов заживления. В начальный период (1-3 суток после
операции) рана заполнена некротическими массами;
распавшимся кровяным сгустком, гноем, мелкими частями кости и зуба.
В других случаях лунка зияет, кровяной сгусток отсутствует, отделяемого
нет, выступающие участки кости альвеолы, не покрытые мягкими тканями и
сгустком крови, при касании резко болезненны. Регионарные лимфатические
узлы могут быть увеличены, болезненны. Нарушается общее состояние больного.
Низкоэнергетическая ЛТ имеет целью устранить боль, стимулировать очищение
раны и рост грануляций (репаративный процесс),а также способствовать десенсибилизации
организма. Она проводится после ирригации лунки зуба физиологическим раствором,
удаления инородных частиц, после сглаживания острых краев альвеолы (или
альвеолэктомии) и высушивания раны марлевым тампоном.
Прямым пучком или с помощью волокнистого световода гелий-неоновое излучение
направляют на устье лунки по ее продольной оси. После процедуры на устье
лунки накладывают стерильный тампон или иодофсрмную турунду. Разовая доза
ЛТ-0,24-4,5 Дж/см2. Продолжительность первой процедуры - 2 мин, последующих
- 4 мин ежедневно. На курс - 2-4 процедуры. При наличии сопутствующего
серозного лимфаденита регионарных лимфатических узлов показано облучение
соответствующей области. Плотность мощности - 0,2-0,4 мВт/см2. Продолжительность
процедуры - 1-2 мин, повторить через 48 часов.
5. Методика лазеротерапии больных с острым и обострившимся хроническим
силаденитом
Неспецифический воспалительный процесс больших слюнных желез (околоушной,
поднижнечелюстной, подъязычной) возникает вследствие проникновения бактериальной
и вирусной инфекции гематогенным или виутрипротоковым путем. Он характеризуется
уменьшением или полным прекращением слюиооттока, припуханием, иногда значительным,
вплоть до образования- абсцесса или йлегмоны, железистой и околожелезистой
ткани. Часто сопровождается резкой болезненностью железы, гноетечением
из протока, нарушением общего состояния.
При хронических сиаладенитах играет роль аутоиммунная сенсибилизация
организма. Периодические к довольно частые обострения приводят к рубцеванию
железы, замещению ее соединительной тканью.
Основные положения, касающиеся этиологии, патогенеза, клиники и лечения
заболеваний слюнных желез изложены в известных руководствах А.В. Клёментова
"Болезни слюнных желез", 1975; И.Ф. Ромачевой с соавторами "Заболевания
и повреждения слюнных желез", 1987; Л.Сазама "Болезни слюнных желез", Прага,
Авиценум и др., 1971.
В настоящей работе описывается ряд последовательных приемов общей и
местной терапии заболеваний слюнных желез с применением гелий-неонового
лазерного излучения.
5.1. Лечение острого сиаладеннта
Воспалительные заболевания больших слюнных желез (сиаладеннты) бывают
острые и хронические. В возникновении острого сиаладеиита, в том числе
эпидемического, принимают участие вирусы и бактерии при снижении сопротивляемости
организма и воздействии различных экзо- и эндогенных факторов. Эпидемический
паротит встречается преимущественно у детей 7-10 лет, взрослые болеют редко.
Острый сиаладенит характеризуется поражением, главным образом, стромы
слюнной железы (отек, гиперемия, небольшая перидуктальная и периваскуальная
инфильтрация нейтрофилами). Наблюдается десквамация протокового эпителия
и дистрофические явления в эпителиальных клетках (набухание, зернистое
помутнение и др.). Глубокие необратимые явления (некроз) и нагноение встречаются
редко.
Кроме противоэпидемических мероприятий, симтоматического и общеукрепляющего
лечения, показано общее и местное воздействие на патогенетические звенья
указанного процесса. Необходимо поддержание постоянного оттока секрета
(путем ежедневного бужирования выводного протока околоушной или поднижнечелюстной
железы, избегая массажа железы), также рекомендуется слюнногонная диета
достаточной калорийности, полупостельный режим, обильное питье. Назначают
лазерную терапию.
Кожные покровы над большой слюнной железой ежедневно однократно обрабатывают
расфокусированным лучом лазера, разовая доза - 0,006-0,012 Дж/см2. Плотность
мощности излучения - 0,1-0,2 мВт/см2, продолжительность-1-2 мин. На курс
лечения обычно требуется 3-4 сеанса, после которых припухлость желез заметно
уменьшается. Суммарная доза - 0,048 Дж/ом2.
Иногда, несмотря на лечение, ухудшается общее состояние больного, увеличенная
железа становится плотной, секрет вязким, мутным с включениями гноя. В
случае тяжелого течения заболевания показано введение в проток антибактериальных
растворов, предпочтительно смеси стафилококкового и стрептококкового бактериофагов
по 0,1-0,3 мл в каждую железу или 0,02 % раствор хлоргексидина. В случае
развития гнойного воспаления лазерную терапию следует прекратить, при необходимости,
больного госпитализировать. По показаниям проводят хирургическое вмешательство
с целью эвакуации, гнойного эксудата и некротических масс.
5.2. Лечение хронического сиададеннта
Неспецифический хронический сиаладенит характеризуется часто довольно
стойким и значительным припуханием железы иногда с образованием гнойного
процесса в железистой и околожелезистой ткани. Рассматривают три основные
формы хронического неспецифического сиаладенита:
паренхиматозный, интерстициальный и сиалодохит, которые различаются
как клиническим течением, так и патологическими изменениями в тканях и
организме больного.
5.2.1. Паренхиматозный сиаладенит чаще возникает в околоушной железе
и характеризуется более частыми обострениями и более бурной, интенсивной
реакцией организма. Патологоанатомически и рентгенологически (сиалографически)
эта форма отличается поражением внутриарган-ных тканей, преимущественно
протоков, сопровождается нарастающим застоем и вязкостью секрета. Медленно
прогрессирующее рубцевание железы приводит к нарушению эвакуации слюны
и сокращению слюнообразования.
При обострении паренхиматозного паротита лечение направлено на снятие
острого воспаления. Местно проводят мероприятия по налаживанию оттока слюны,
затрудненного в этой фазе процесса. Лазерную терапию назначают с целью
уменьшения болей, отека тканей, повышения резистентности тканей и десенсибилизации
организма.
Поверхность кожи над железой обрабатывают резко расфокусированным пучком
лазерного света (размер пятна около 10 см) при ПМИ 0,02-0,04 мВт/см2 и
продолжительности 1-2 мин. После 2-3 процедур воспалительные явления обычно
стихают, исчезают боль и общее недомогание, усиливается слюноотделение,
уменьшается припухлость железы. Лазерную терапию продолжают до 10-12 процедур,
постепенно повышая ПМИ до O.h^-0,2 мВт/см2. По окончании лазерного сеанса
на воспаленную железу накладываютсухую согревающую повязку. Внутрь назначают
антибактериальные препараты.
После ликвидации острого воспаления рекомендуется сделать перерыв в
лечении. Через месяц можно приступить к уточнению диагноза, выявлению,
хронической формы сиаладенита, провести санацию полости рта.
В период ремиссии хронического паренхиматозного сиаладенита раз в 3-6
месяцев проводят комплексное лечение, направленное на санацию хронических
одонтогенных и неодонтогенных очагов воспаления - источников инфицирования
больших слюнных желез.
С целью десенсибилизации организма, повышения функции железы, замедления
склероза (рубцевания) железы или восстановления утраченной ею структуры
проводят лазерную терапию. Поверхность кожи, соответствующую расположению
железы, обрабатывают расфокусированным лучом лазера ПМИ 1-1,5 мВт/см2 в
1-2 участках общей продолжительностью 5-10 мин. На курс лечения назначают
10 процедур (суммарная доза-0,3-0,9 Дж/см2). Лазерную терапию повторяют
2-3 раза в год до исчезновения обострении.
5.2.2. Хронический интерстициальный сиаладенит характеризуется, наряду
со склерозом, усиленной инфильтрацией железы лимфоцитами, преимущественно
молодыми формами, сдавливающими слюнные протоки всех калибров, особенно
внутрижелезистые.
Лечение этого недуга направлено на повышение обмена веществ в железе,
уменьшение лимфоцитарной инфильтрации, десенсибилизацию организма и поддержание
оттока секрета.
В период обострения воспаления проводят осторожное бужирование выводного
протока; после получения первых порций слюны приступают на 2-3 день к инстилляции
в проток смеси стафило- и стрептококкового бактериофагов. Возможно применение
и других антибактериальных препаратов нераздражающего действия и не сенсибилизирующих
организм.
С первого дня поступления больного в стационар начинают лазерное лечение
с очень малых доз 0,003 Дж/см2 и затем доводят що 0,3 Дж/см2. Сначала ПМИ
составляет 0,04-0,06 мВт/см2, экспозиция - 1 мин. После заметного стихания
воспаления, уменьшения припухлости и возобновления секреции время облучения
увеличивают до 2, а затем до 5 мин при плотности мощности 0,2-0,8-1,3 мВт/см2.
Ежедневно на ночь больным накладывают на железу масляный компресс.
Во время ремиссии хронического интерстициального сиаладенита применяют
комплекс, состоящий из одновременного внутримышечного введения витаминов
группы С и В и 1 % или 0,5 % раствора галантамина подкожно. Галантамин
- антикурареподобное вещество, усиливающее секрецию пищеварительных желез).
Лазерную терапию у этой группы больных применяют самостоятельно или
вместе с внутривенными инъекциями кальция глюконата ("Ю мл .10 % раствора,
10 инъекций), 1 мл 5 % раствора пиридоксина, внутримышечно, № 10. Расфокусированным
лучом лазера ПМИ 0,8-1,5 мВт/см2 обрабатывают область расположения железы
с увеличивающейся ежедневно экспозицией 2, 3, 5, 7, 10 мин и далее по 10
мин 8-10 сеансов или по 5 мин ежедневно в течение 10 дней. Суммарная доза
- 0,9 Дж/см2.
Подобный курс лечения повторяют через 3-6 месяцев.
5.2.3. При хроническом сиалодохите терапия направленана сохранение
функции и восстановление структуры железы.
Это заболевание характеризуется подострым течением с относительно частыми
обострениями, сопровождающимися припуханием желез (чаще всего околоушных),
застоем секрета, обусловленного неравномерной дила-тацией (расширением)
главного и внутриорганных протоков, а также изменением консистенции и инфицнрованием
секрета.
В стадии обострения сиалодохита принято проводить инстилляцию (при
необходимости после бужирования протока) антисептическими растворами (0,02-0,05
% раствором хлоргексидина, смесью бактериофагов или антибиотиков, при назначении
последних для длительного применения. Одновременно поверхность кожи над
пораженной железой обрабатывают прямым расфокусированным лучом лазера.
Сначала используют ПМИ 0,1 мВт/см2 и экспозицию 2 мин. После 2-3 сеансов
ПМИ и экспозицию увеличивают соответственно до 1-2,5 мВт/см2 и 5-6 минут.
На курс лечения - до 10 сеансов. Суммарная доза - 9 Дж/см2.
В период полной или. неполной ремиссии хронического сиалодохита, для
профилактики обострении необходимо поддерживать адекватный отток секрета,
для чего раз в 3-6 мес. производят бужирование выводного протока, антибактериальную
обработку содержимого, а также внутрипротоковое облучение его стенок гелий-неоновым
лазером с помощью специального световода диаметром до 0,04 см. Плавное
продвижение световода по всей длине протока до его перехода в паренхиму
и обратно производится в течение 1,5-2 мин, при этом на торце световода
ПМИ равна 955 мВт/см2. В потоке слюны лучи лазера резко расходятся, действующая
ПМИ снижается. Внутрипротоковое облучение можно проводить и в период обострения
процесса, однако рассчитывать на бактерицидное действие лучей лазера не
приходится. Потом прямыми лучами лазера (примерная доза ЛТ 4,5-5,4 Дж/см2)
обрабатывают кожу над железой (ПМИ - 1,5-2 мВт/см2, продолжительность -
5-6 мин, на курс - 7-10 сеансов). Одновременно с ЛТ назначают инъекции
витамина Вд (пиридоксина) 1 мл 5% раствора внутримышечно и 10 мл 10% раствора
кальция глюконата внутривенно по 10-инъекций.
Если сиалодохит связан с резкой констрикцией выводного протока или
рубцовой деформацией тканей в области протока, то эти участки облучают
при ПМИ 11-18 мВт/см2 в течение 10-20 минут ежедневно в течение 12-15 дней.
Доза ЛТ- 2,4-6 Дж/см2.
Лечение хронического неспецифического сиаладенита независимо от формы
проводят несколькими курсами.
5.2.4. Болезнь и синдром Шегрена (СШ) характеризуются сухостью во рту
и дискомфортом со стороны глаз (сухость, резь, светобоязнь, нарушение зрения,
скопление путридных масс). Эти симптомы развиваются на фоне всех форм хронического
неспецифического сиаладенита, сухого кератоконыонктивита и других проявлений
системных заболеваний соединительной ткани (ревматоидного артрита, красной
волчанки и др.).
Лечение этих заболеваний (БШ и СШ.) строится с учетом характера течения
заболевания слюнных и слезных желез и других симптомов системных заболеваний
с обязательным включением инъекций витаминов Bg и Б);, раствора кальция
глюконата (см. выше) и нескольких курсов ЛТ. Доза ЛТ на один курс составляет
3-7,8 Дж/см2. Область лица над околоушной или подчелюстной железой с обеих
сторон обрабатывают расфокусированным неподвижным лучом лазера с диаметром
пятна 1- 0,8 см2 по 5-10 мин (ПМИ 1,8-1,3 мВт/см2), ежедневно в течение
10 дней. Область слезных желез (верхне-латеральный край глазницы) облучают
при опущенных веках (ПМИ 11-18 мВт/см2) в течение 1 мин прямым лучом или
с помощью гибкого световода также в течение 10 дней. Доза-6,6-10 Дж/см2
(диаметр светового пятна-0,3 см).
В случае, когда не удается достичь значительного или стойкого улучшения,
целесообразно дополнительно обрабатывать широким лучом лазера (ПМИ - 0,25-0,5
мВт/см2, экспозиция - 4 мин) слизистую оболочку губ и рта, т. е. малые
слюнные железы, суммарное время облучения - 12-15 мин (разовая доза ЛТ-0,06-0,12
Дж/см2).
Поддерживающую лазерную терапию при БШ и СШ следует проводить через
каждые 2-4 месяца до получения стойкого положительного результата и исчезновения
жалоб со стороны рта и глаз.
5.3. Ксеростомия - заболевание, характеризующееся снижением функции
слюнных желез, когда органические изменения в слюнных и слезных железах,
как правило, не выявлены.
Лазерная терапия направлена на восстановление слюнообразования, путем
улучшения трофики слюнных желез.
Для этой цели пучок лазерного излучения диаметром 10 мм -направляют
на область околоушной (под мочкой уха) и поднижнечелюстной железы с обеих
сторон. Разовая доза ЛТ- 0,3-0,13 Дж/см2 при ПМИ 0,4-0,6 мВт/см2, продолжительность
воздействия - 5 или 10 мин. Суммарная -доза в пределах 3-4,5 Дж/см2 на
курс лечения. Повторный курс лазерного лечения целесообразно проводить
при отсутствии положительного результата в период от 3-4 недель до 2-3
месяцев. В ряде случаев, как и при болезни Шегреиа, целесообразно одновременно
с лазерным воздействием назначать инъекции растворов кальция глюконата
и пиридоксина.
Комплексное лечение с применением гелий-неонового лазера острого и
хронического неспецифического сиаладенита весьма длительное, требует многократного
повторения, должно сочетаться с общеукрепляющими мероприятиями: занятиями
физкультурой, нормализацией условий труда и отдыха, санацией всех воспалительных
очагов организма. Такое комплексное лечение обеспечивает сокращение числа
и частоты обострении, более легкое течение, удлинение ремиссий от нескольких
месяцев до нескольких лет. Строгое соблюдение предлагаемой схемы лечения
позволяет в большинстве случаев избежать хирургического вмешательства.
Нередко достигается частичное или полное восстановление утраченной структуры
слюнной железы, устранение органических повреждений роговицы и конъюнктивы.
6. Методика лазеротерапии больных с эрозией слизистой оболочки рта
(эрозивно-язвенная форма красного плоского лишая, многоформная эксудатямая
эритема и др.)
Поражение слизистой оболочки рта по типу красного плоского лишая, многоформной
эксудативной эритемы, рецидивирующего афтозного стоматита др. заболеваний
с неясной этиологией и патогенезом причиняют больным длительные страдания,
плохо поддаются лечению. Они сопровождаются болью, особенно при приеме
пищи, разговоре, пользовании съемными протезами.
Лазерная терапия наиболее тяжелой формы красного плоского лишая, эрозивно-язвенной
и булезной, направлена на купирование боли, воспалительных изменений, десенсибилизацию
организма, а также на очищение от некротических тканей и заживление язв
и эрозий без образования рубцов и деформаций.
Ее целесообразно применять в комплексе с местным и общим лечением,
сопровождающимся санацией полости рта и всего организма.
Прямым расфокусированным лазерным пучком облучают очаг поражения на
слизистой оболочке щеки, десны, свода рта, языка, неба и др. Труднодоступные
участки обрабатываются с помощью световода. Разовая доза на объект составляет
0,12-0,18 Дж/см2. Продолжительность воздействия следует постепенно увеличивать
от 2 до 6 мин. На курс лечения необходимо 1,16-3,4 Дж/см2. Проводят 1-5
сеансов до ликвидации гиперемии, эпителизации очагов и исчезновения субъективных
ощущений.
7. Методика лазеротерапии больных с дисфункцией, артритом или артрозом
височно-нижнечелюстного сустава
Заболевания височно-нижнечелюстного сустава обусловлены функциональными
и органическими нарушениями как внесуставных тканей (зубочелюстная система,
жевательные мышцы, связочный аппарат, нервная ткань), так и суставных элементов
(головка нижней челюсти, нижнечелюстная ямка, хрящ, капсула). Клинические
проявления характеризуются пощелкиванием, постоянной или периодической
болью в области височно-нижнечелюстного сустава (ВНЧС), чаще разлитой,
усиливающейся при движении нижней челюсти и головы. Иногда на первый план
выступает острое воспаление, образуется небольшая припухлость тканей над
суставом. Часто во время движения нижней челюсти имеется крепитапия, хруст
'в области сустава. Может наблюдаться неправильное положение головки или
всей нижней челюсти, а также нарушение траектории ее движения.
Низкоэнергетическая лазеротерапия направлена на ликвидацию воспаления,
боли и явлений тонического сокращения жевательных мышц, а также на десенсибилизацию
организма.
Режим лазерного лечения нарушений ВЧНС зависит от степени и характера
поражения суставных и околосуставных тканей и должен сочетаться с мерами
по устранению нарушений жевательного аппарата.
7.1. При отсутствии структурных изменений в суставах и зубочелюстной
системе (дисфункция ВНЧС) ЛТ подлежат следующие участки:
область сустава - кпереди от козелка уха под скуловой дугой, область
угла нижней челюсти - собственно жевательная мышца, крыловидно-челюстная
складка - внутренняя крыловидная и височная мышцы, область бугра верхней
челюсти - наружная крыловидная мышца. Суммарная доза - 3-43,2 Дж/см2. Диаметр
лазерного пятна - 0,5 см. Плотность мощности излучения - 4-6 мВт/см2. Продолжительность
процедуры - 1-4 мин на каждый участок ежедневно. Курс лечения 10-12 процедур.
7.2. При наличии острого процесса и структурных изменений в суставах
или отсутствия эффекта лечения по варианту I.
Расфокусированный пучок лазерного света под прямым углом направляют
на область сустава. Доза - 3-10,8 Дж/см2. При двустороннем поражении облучают
последовательно оба сустава. Воздействие на область жевательных мышц проводят
по методике варианта I. Плотность мощности излучения при воздействии на
сустав составляет 1-1,5 мВт/см2. Продолжительность процедуры облучения-5-10
минут ежедневно. Суммарное время облучения области одного сустава - 10-15
мин., двух суставов не более 20 мин. На курс лечения - 10-12 процедур.
7.3. Лазерную терапию хронического воспаления ВНЧС проводят курсами
(от 1 до 4) с перерывами между ними 1-2 месяца по методике варианта II.
Эффект лазерного лечения заболеваний ВНЧС может быть стойким при условии
устранения сопутствующих заболеваний в смежных областях (зубочелюстной
системе, лор-органах, суставах).
25
8. Методика лазеротерапии больных с невритом и невралгией тройничного
нерва
Лицевые боли в областях, иннервируемых ветвями тройничного нерва, обусловлены
нарушением функционального состояния, органическими изменениями периферических
стволов и рецепторов этого нерва, а также структурных элементов центральной
нервной системы (продолговатого мозга, диэнцефальной и корковой области)
и прилежащих костных образований.
Лазерная терапия направлена на устранение сосудистой недостаточности,
улучшение трофики и обмена веществ в нервных стволах, их окончаниях, прилежащих
тканях. К ЛТ приступают после ликвидации всех очагов воспаления челюстно-лицевой
области, которые могут быть причиной возникновения болей.
В начальной стадии болезни рекомендуется небольшая доза - 0,007-0,025
Дж/см2. Плотность мощности излучения - 0,1-0,4 мВт/см2. Продолжительность
процедуры - 1-4 мин, ежедневно повышая на 1 мин., довести до 5-10 мин.
На курс лечения- 10-12 процедур. Суммарная доза ЛТ-0,36-1,14 Дж/см2. Целесообразно
проводить повторные (поддерживающие) курсы через 2-4 недели. В случае рецидива
болезни недостаточности или неэффективности описанной методики следует
увеличить ПМИ до 1-1,5 мВт/см2. Продолжительность процедуры,-5- 10 мин,
ежедневно или через день. Если больной получает противосудорожные препараты,
то частоту приема этих средств следует сокращать постепенно, до полной
отмены.
9. МЕТОДИКА ЛАЗЕРОТЕРАПИИ БОЛЬНЫХ С ПУЗЫРЬКОВЫМ ЛИШАЕМ
Пузырьковый или простой лишай (Herpes Simplex) - инфекционное заболевание
вирусного происхождения, характеризующееся острым высыпанием Мелких пузырьков
на коже и слизистой оболочке в области рта, носа, щеки и др. Высыпания
сопровождаются ощущением зуда, жжения или боли.
Лазерное воздействие направлено на ликвидацию боли, десенсибилизацию
организма, ускорение вскрытия пузырьков и заживления эрозий.
Световому лазерному воздействию подлежат очаги скопления пузырей или
эрозий. Разовая доза-1-1,6 Дж/см2. Плотность мощности излучения - 4-6 мВт/см2.
Продолжительность процедуры - 4 мин ежедневно. На курс лечения - 2-4 процедуры.
Лазерное лечение пузырькового лишая может быть успешным лишь в начальной
стадии болезни при поражении небольшой площади покровных тканей и нерезко
выраженной аллергической реакции организма.
10. Методика лазеротерапии при переломе челюсти
Повреждение лицевого скелета сопровождается разрывом и разможжением
мягких тканей, образованием ран, гематом, травматическим воспалительным
отеком и инфильтрацией тканей, болью, усиливающейся при движении нижней
челюсти, головы и приеме пищи.
Лазерная терапия направлена на ликвидацию боли и воспалительной реакции
тканей, восстановление проводимости нижнеальвеолярного или подглазничного
нерва и нормализации репаративной регенерации поврежденных тканей.
Лазерную терапию проводят начиная с 2-х суток после перелома, репозиции
и иммобилизации отломков челюсти, скуловой кости. При наличии припухлости
околочелюстных тканей эту область в течение 1-3 суток облучают лазерным
пучком 2-3 см2 и более. Плотность излучения - 0,2-0,5 мВт/см2. Продолжительность
процедуры - 1-2 минуты ежедневно. После стихания воспаления мягких тканей
лазерной обработке подвергается поверхность кожи над каждым участком поврежденной
кости. Доза облучения - 0,24-0,4 Дж/см2. Плотность мощности излучения -
0,8-6 мВт/см2. Продолжительность процедуры - 5 мин. ежедневно. Средняя
суммарная доза на один участок - 3-3,8 Дж/см2.
| Диаметр
пятна, см |
Площадь пятна, см1 | Мощность аппарата | на выходе | |||||
| 0,4 | 0.8 | 1.0 | 1.2 | 1.3 | 2,0 | 2.5 | ||
| 0,04 | 0,0013 | 636,9 | 796,1 | 955,4 | 1035,0 | 1592,3 | 1990.4 | |
| 0.3 | 0.07 | 5.7 | 11,4 | 14.2 | 17,1 | 18,6 | 28.6 | 35,7 |
| 0,5 | 0,2 | 2.0 | 4.0 | 5.0 | 6,0 | 6.5 | 10,0 | 12,5 |
| 0.8 | 0,5 | 0.8 | 1,6 | 2.0 | 2,4 | 2,6 | 4,0 | 5,0 |
| 1,0 | 0.8 | 0,5 | 1.0 | 1.3 | 1.5 | 1.6 | 2,5 | 3.1 |
| 1.3 | 1.3 | 0,3 | 0,6 | 0,8 | 0.9 | 1.0 | 1.5 | 1.9 |
| 1,5 | 1.8 | 0.2 | 0.4 | 0.6 | 0,7 | 0,7 | 1,1 | 1.49 |
| 2.0 | 3,14 | 0,1 | 0,25 | 0.3 | 0,4 | 0.4 | 0,64 | 0,8 |
| 2.5 | 4,9 | 0.2 | 0.2 | 0,24 | 0.3 | 0.41 | 0.51 | |
| 3,0 | 7.1 | 0,1 | 0,14 | 0,17 | 0.18 | 0,28 | 0,35 | |
| 5,0 | 19,6 | 0,04 | 0,05 | 0.06 | 0.07 | 0,1 | 0,13 | |
| 8.0 | 50,2 | 0,02 | 0.02 | 0,02 | 0,03 | 0,04 | 0,05 | |
Правила проведения процедур низкоэнергетическим лазером ЛТМ-01 стоматологическим
больным
1. Лазеротерапию необходимо проводить в хорошо освещенном и проветриваемом
помещении.
2. Во время процедуры лицо больного должно быть обращено к источнику
света (окно, лампа накаливания 100-150 Вт).
3. До процедуры больной должен находиться в покое в хорошо освещенном
помещении в течение 15-20 минут.
4. После процедуры больной отдыхает в течение 10-15 минут.
5. Во время процедуры лазеротерапии запрещается чтение, разговоры,
движения.
6. Больным с лабильной нервной системой, а также при склонности к повышению
артериального давления, до и после процедуры необходимо измерять артериальное
давление; результат регистрировать в амбулаторной карте или процедурном
листе.
7. Больные, отмечавшие накануне нарушение самочувствия, должны предупредить
об этом врача или медсестру.
8. Для медперсонала, проводящего процедуру, и больных обязательно ношение
светозащитных очков.



Термические свойства ткани
Действие лазера в хирургии в качестве режущего инструмента или коагулятора,
базируется на превращении электромагнитной энергии лазерного луча в тепловую
энергию. Эффект рассечения ткани СО2-лазером основан на сильном поглощении
излучения водой. Глубина проникновения излучения в ткань составляет для
СО2-лазера около 0,1 мм. Поглощенный в этом тонком слое свет преобразуется
в тепло и мгновенно приводит к температурам более 300°С и, как следствие,
к выпариванию ткани. Это обстоятельство и позволяет использовать данный
лазер для рассечения ткани. При использовании СО2-лазера скорость рассечения
зависит от плотности мощности.
Свойства лазера в отношении воздействия на слизистую оболочку и мышечную
ткань указаны на рис. 4.
При воздействии СО2-лазера на мягкие ткани зона необратимых термических
некрозов сводится к минимуму, так как глубина проникновения луча составляет
менее 0,1 мм, что позволяет использовать именно этот тип лазера в практической
стоматологии.



Рис. 6a. |

Рис. 6b. |

Рис. 7. |

Рис. 8a. |

Рис. 8b. |

Рис. 9. |

Рис. 10. |

Рис. 11. |

Рис. 12. |

Рис. 13. |

Рис. 14. |

Рис. 15. |

Рис. 16. |

Рис. 17. |

Рис. 18. |

Рис. 19. |
Таблица 1. Типы лазеров, глубина проникновения и хромофоры.
| Лазер | Длина волны, нм | Глубина проникновения, мкм (мм)* | Поглощающий хромофор | Типы ткани | Лазеры, используемые в стоматологии |
| Nd: YAG с удвоением частоты | 532 | 1330 (1,33) | Меланин, Кровь | Мягкие | + |
| Импульсный на красителе | 585 | 2000 (2,00) | Меланин, Кровь | Мягкие | + |
| He-Ne (гелий-неоновый) | 633 | 4000 (4,00) | Меланин, Кровь | Мягкие, терапия | ++++ |
| Рубиновый | 694 | 3,990 (3,99) | Меланин, Кровь | - | |
| Александритовый | 755 | 4320 (4,32) | Меланин,Кровь | - | |
| Диодный | 830
980 |
4000 (4,00)
1300 (1,3) |
Меланин, Кровь | Мягкие, отбеливание | ++++
+++ |
| Неодимовый (Nd:YAG) | 1064 | 5315 (5,31) | Меланин, Кровь | Мягкие | ++ |
| Гольдмиевый (Ho:YAG) | 2100 | 665 (0,66) | Вода | Мягкие | + |
| Эрбиевый (Er:YAG)/td> | 2780
2940 |
70 (0,07)
3 (0,003) |
Вода
Вода |
Твердые (мягкие)
Твердые (мягкие |
++
++++ |
| Углекислотный (СО2) | 9600
10600 |
50 (0,05)
65 (0,065) |
Вода
Вода |
Твердые (мягкие)
Мягкие |
++
++++ |
В стоматологии наиболее часто применяют СО2- лазер для воздействия на
мягкие ткани, и эрбиевый лазер для препарирования твердых тканей.
Режим работы лазеров и их энергетика.
Эрбиевый:
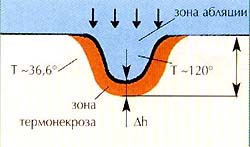
| Температура | Визуальные изменения | Биологические изменения |
| 50-60°С | Нет | Нагрев |
| 60-70°С | Обесцвечивание | Порог коагуляции (некроза) |
| 65-90°С | Белый/серый | Денатурация ткани |
| 90-100°С | Сморщивание (эффект "попкорна") | Вакуолизация |
| 100°С (латентный нагрев) | "Перья дыма" | Вапоризация, карбонизация |



Рис. 5 Полость, подготовленная высокоскоростной турбиной. (20-кратное увеличение).Поверхность стенок прямая, перпендикулярная внешней поверхности зуба, требует финирования. На дне и стенках видны царапины от алмазного бора и следы смазанного слоя. |

Рис. 6 Полость, подготовленная эрбиевым лазером. (20-кратное увеличение).Поверхность стенок ровная, края закруглены, на эмали видна вытравка, полость не имеет смазанного слоя. |
Инструкция рекомендована комиссией по аппаратам, приборам, инструментам
и материалам, применяемым в стоматологии, Комитета по новой медицинской
техника Министерства здравоохранения и медицинской промышленности РФ (протокол
№ в от 30 сентября 1993 г.).
"УТВЕРЖДАЮ" Заместитель Начальника Управления научных исследований
Министерства здравоохранения м медицинской промышленности РФ
В.Е.Бельгов 2 августа 1994 г.
1. НАЗНАЧЕНИЕ АППАРАТА.
Лазерный аппарат «Оптодан» с полупроводниковым излучателем на арсенидо
галлия с длиной волны 0.85-0.95 мкм является физиотерапевтическим светолечебным
прибором для применения в физиотерапевтических кабинетах (отделениях) поликлиник
и больниц, а также непосредственно на рабочих местах врачей (операционные,
перевязочные, процедурные м т.п.}, стоматологических лечебных учреждений
для лечения стоматологических заболеваний.
Лазерный аппарат «Оптодан» разрешен к промышленному выпуску и клиническому
применению решением (протокол NB 2 от 25 март 1993 г.) Комиссии по аппаратам,
приборам, инструментам и материалам, применяемым стоматологии. Комитата
по новой медицинской техника Министерства здравоохранения и медицинской
промышленности РФ, сертификат ГОСТАНДАРТА РФ № РОСС RU ИМО 2801048, защищен
патентом РФ № 2014107 от 16.12.92г.
2. ТЕХНИЧЕСКИЕ ХАРАКТЕРИСТИКИ
Длина волны лазерного света, мкм 0.85 -0,98
Мощность импульса лазерного света, Вт не менее 2
Максимальная средняя мощность излучения, мВт
Режим I 0,055
Режим II 1,65
Частота повторения импульсов, Гц
Режим I 80-100
Режим II 2000-3000
Длительность импульса лазерного излучения, нс 40-100
Питание; напряжение, В /частота, Гц/ 220/50/
потребляемая мощность, Вт на более 10
Масса, кг/Габариты, см 0,8/6х12х18
Средний срок службы, лет 5
ВНИМАНИЕ!
1. Аппарат «Оптодан» относится к классу 1 требований по лазерной безопасности
"Санитарных норм и правил устройства и эксплуатации лазеров" (5804 - 91)
Госкомсанэпиднадзора РФ.
2. Аппарат относится к классу 2 , типу В требований электробезопасности
по ГОСТ Р 50207 (заземления на требуется, для включения в электросеть используется
обычная 2-х щтырьковая вилка).
3. Дезинфекцию наконечника (и насадок) лазерного получателя осуществляют
согласно ОС 42-21-85 и путем протирания ватным тампоном, смоченным одним
из следующих дезинфицирующих растворов:
- 0,05%-ный спиртовой раствор хлоргексидина;
- 70 % этиловый спирт;
- смесь 3%-ных растворов аммиака и перекиси водорода в соотношении
1:1;
- тройной раствор: формалин 2%, фенол 0,3%, натрий двууглекислый 1,5%,
дистилированной воды 100 мл.
ВНИМАНИЕ!
Перед протиранием наконечника насадок смоченный дезинфицирующим раствором
тампон следует отжать.
Не допускается погружение наконечника в указанные выше растворы.
Стерилизация наконечника лазерного аппарата с применением высокой (свыше
40 С') температуры не допускается во избежание его повреждения.
Общий вид лазерного аппарата "Оптодан' с указанием элементов управления
сипплизации приведен на Рис. 1.

3. ПОРЯДОК РАБОТЫ С АППАРАТОМ
Перед включением аппарата а электросеть необходимо проверить положение
клавиши 14 "Сеть", которая должна находиться в положение "Выкл".
Сетевой шнур аппарата включают в сеть переменного тока напряжением
220 В и устанавливают клавишу 14 в положение "Вкп". при этом на индикаторе
таймерного устройства - 2 высвечиваются цифры "0000" и, одновременно, высвечивается
индикатор канала "1" - 3. После включения аппарата допускается появление
мигающей точки между разрядами "0000" таймерного индикатора - 2.
После 2-х кратного нажатия клавиши - 10 ("Время"), на индикаторе таймерного
устройства -2 высвечиваются цифры - "5555" ( при этом мигание точки не
допускается: для ее устранения нажимают клавишу -10 ("Время")).
Нажатием клавиши • в ("Мин") и клавиши 11 ("Сек") устанавливают необходимое
время (экспозицию) облучения.
Если величина экспозиции при ее установка завышена, необходимо с помощью
клавиши -14 "Сеть") выключить и снова включить аппарат и операцию установки
экспозиции повторить, т.к. таймерное устройство не имеет обратной установки
минут и секунд.
Нажатием клавиши - 4 ("I") или клавиши - 5 ("II") установите требуемый
частотный канал, при этом высвечивается индикатор - 3 или индикатор - в.
Для включения лазерного излучателя нажимают клавишу- 13 ("Лазер"),
при этом высвечивается индикатор лазерного излучения - 13 и -начинается
обратный отсчет от установленного на индикаторе таймерного устройства -2
времени экспозиции.
По истечению заданной экспозиции таймерное устройство отключает лазерный
излучатель, индикатор лазерного излучения -13 гаснет, и при этом. одновременно,
подается звуковой сигал и на индикаторе таймерного устройства высвечиваются
"0000" и изображение колокольчика.
Для повторения процедуры без изменения времени экспозиции нажмите клавишу
-12 ("Лазер") при этом таймерное устройство автоматически устанавливает
заданное время и включает лазерный излучатель.
Для изменения времени экспозиции нажимают клавишу - 10 ("Время") и
нажатием клавиши • 9 ("Мин") и клавиши -11 ("Сек") изменяют время.
Для проверки работы излучателя с помощью клавиши - 9 ("Мин") и клавиши
-10 ("Сек") установите время экспозиции 10 Сек., затем нажатием клавиши
- 5 ("II") включите 2-ой частотный канал, наконечник излучателя встаете
в гнездо - 7 ("Контроль лазера") и нажмите клавишу - 13 "Лазер"), при работающем
лазере высвечивается индикатор - 8 ("Контроль лазера").
Проверку работы лазерного излучателя рекомендуется проводить не менее
2-х раз: в начале и в конце работы. Если лазерный аппарат периодически
отключается от электросети после каждого включения аппарата.
4 МЕРЫ ПРЕДОСТОРОЖНОСТИ И ТЕХНИКА БЕЗОПАСНОСТИ
При работе с лазерным аппаратом соблюдают все меры предосторожности,
предусмотренные для светолечебных физиотерапевтических приборов и лазерных
аппаратов согласно "Санитарных норм и правил устройства и эксплуатации
лазеров" № 5804 -91.
ВНИМАНИЕ! Излучение аппарата с длиной волны 0.89 - 0.99 мкм относятся
к невидимому участку ИК-области спектра.
Для предупреждения травм электрическим током вскрывать включенный а
электросеть лазерный аппарат КАТЕГОРИЧЕСКИ ВОСПРЕЩАЕТСЯ.
5. ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ К ПРИМЕНЕНИЮ ЛАЗЕРНОГО СВЕТА
ПОКАЗАНИЯ. Терапевтические свойства лазерного света позволяют применять
физиотерапевтический лазерный аппарат "ОПТОДАН* для лечения основных стоматологических
заболеваний, в первую очередь кариес зубов, заболевания пародонта и др.
ПРОТИВОПОКАЗАНИЯ К ПРИМЕНЕНИЮ ЛАЗЕРНОГО СВЕТА ОПРЕДЕЛЯЮТСЯ ИСХОДЯ ИЗ
ОБЩИХ ПРОТИВОПОКАЗАНИЙ К ПРИМЕНЕНИЮ ФИЗИОТЕРАПЕВТИЧЕСКИХ СВЕТОЛЕЧЕБНЫХ
ПРИБОРОВ С УЧЕТОМ РЯДА УКАЗАННЫХ ВЫШЕ СВОЙСТВ И ОСОБЕННОСТЕЙ ЛАЗЕРНОГО
СВЕТА:
ТЯЖЕЛО ПРОТЕКАЮЩИЕ ЗАБОЛЕВАНИЯ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ;
НАРУШЕНИЕ СЕРДЕЧНОГО РИТМА;
АТЕРОСКЛЕРОЗ;
КАРДИОСКЛЕРОЗ С ВЫРАЖЕННЫМ НАРУШЕНИЕМ КОРОНАРНОГО КРОВООБРАЩЕНИЯ;
ЦЕРЕБРАЛЬНЫЙ СКЛЕРОЗ С НАРУШЕНИЕМ МОЗГОВОГО КРОВООБРАЩЕНИЯ;
АНЕВРИЗМА АОРТЫ;
НЕДОСТАТОЧНОСТЬ КРОВООБРАЩЕНИЯ И СТЕПЕНИ;
ЗАБОЛЕВАНИЕ КРОВИ;
ЗАБОЛЕВАНИЯ НЕРВНОЙ СИСТЕМЫ С РЕЗКО ПОВЫШЕННОЙ ВОЗБУДИМОСТЬЮ;
ТЯЖЕЛАЯ СТЕПЕНЬ САХАРНОГО ДИАБЕТА В НЕКОМПЕНСИРОВАННОМ СОСТОЯНИИ
ИЛИ ПРИ
НЕУСТОЙЧИВОЙ КОМПЕНСАЦИИ;
ГИПЕРТЕРИОЗ;
ВЫРАЖЕННАЯ И ТЯЖЕЛАЯ СТЕПЕНЬ ЭМФИЗЕМЫ ЛЕГКИХ;
ФУНКЦИОНАЛЬНАЯ НЕДОСТАТОЧНОСТЬ ПОЧЕК;
ОПУХОЛИ ЗЛОКАЧЕСТВЕННЫЕ;
6. ЛЕЧЕНИЕ СТОМАТОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ
В соответствии с известными механизмами лечебного действия полупроводниковых
физиотерапевтических лазерных аппаратов лечение стоматологических заболеваний
осуществляется обычно в два периода. В первый период, при воспалении тканей
(пульпа зуба. слизистая оболочка полости рта, кожа лица, челюстные кости)
проводят лечебные процедуры с применением так называемых противовоспалительных
параметров, используя частотный канал "I" лазерного аппарата. После купирования
(ликвидации) воспаления, что определяют клинически или с помощью средств
функциональной диагностики - рео -, фотоплетизмография стимулирующие регенерацию
(нормализацию) тканей параметры, используя частотный канал "II".